Blog
SOFTWARE AS A MEDICAL DEVICE (SaMD) : CLINICAL EVALUATION
Aufgrund der speziellen Charakteristika von Software as Medical Device (SaMD), veröffentlichte die FDA am 14. Oktober einen Entwurf eines Guidance Documents, welches sich nun eingehend der Thematik der klinischen Bewertung widmet (Link). Korrekterweise ist zu erwähnen, dass die FDA das Dokument des Investigator Medical Device Regulators Forum (IMDRF) übernommen hat und dieses um Formalitäten erweiterte. Eines vorweg - das Ausmaß der klinischen Bewertung ist sinnvollerweise vom Risikopotential des SaMDs abhängig. Die Idee der FDA / des IMDRFs zur Einschätzung des Risikopotentials von SaMDs ist detailliert in diesem IMDRF-Dokument geschildert. Untenstehend möchten wir nun also überblicksmäßig auf die Bestimmung des Risikopotentials und in weiterer Folge auf die Elemente der klinischen Bewertung eingehen. Abschließend wird der Zusammenhang dieser beiden Komponenten dargestellt.
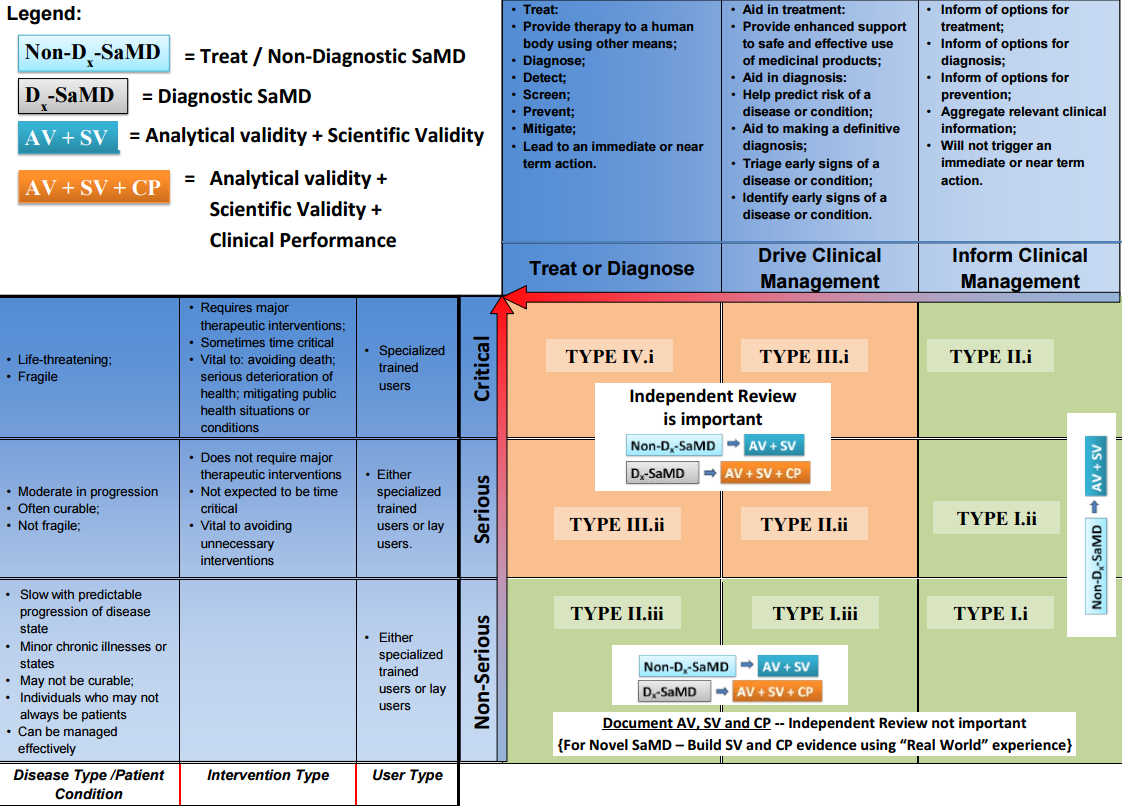
Risikopotential
Zusammengefasst werden zwei Gesichtspunkte zur Einschätzung herangezogen:
- die Signifikanz des Outputs des SaMDs hinsichtlich der klinischen Anwendung (untenstehende Grafik - horizontale Achse) und
- die Kritikalität der klinischen Anwendung hinsichtlich Krankheitsbild, Nutzergruppe und Typ der Intervention führen zu einer Einteilung in unkritisch, schwerwiegend oder kritisch (untenstehende Grafik - vertikale Achse)
Die Signifikanz bezieht sich hierbei auf die Tatsache, ob der Output
- direkt klinische Entscheidungen über die Behandlung / die Therapie / die Diagnose trifft,
- klinische Entscheidungen anleitet und unterstützt,
- über mögliche klinische Entscheidungen informiert.
Untenstehende Grafik stellt nun diese beiden Komponenten dar und deutet bereits den Zusammenhang mit dem Ausmaß der geforderten klinischen Evidenz an.
Clinical Evidence - die drei Säulen
Die klinische Evidenz aus Sicht der FDA stützt sich auf drei wesentliche Säulen, welche je nach Risikopotential in unterschiedlichem Ausmaß gegeben sein müssen (vergleichbar mit der Leistungsbewertung bei IVDs):
- Analytische Validität (Analytical Validity, AV)
- Wissenschaftliche Validität (Scientific Validity, SV)
- Klinische Leistungsfähigkeit (Clinical Performance, CP)
| Komponente | Zielsetzung | Methodik | Erfolgsparameter | Beispiel |
|---|---|---|---|---|
| Analytische Validität | Analytischer Zusammenhang zwischen Input und Output des SaMDs | Literaturrecherche, präklinische Studien, klinische Studien (zB für die Probenentnahme), Post-Market Aktivitäten | klinische Genauigkeit, Präzision (Wiederholbarkeit, Reproduzierbarkeit), Grenzwerte, Linearität, Analytische Sensitivität | Reproduzierbarkeit - CT Bilder des selben Patienten und von verschiedenen Aufnahmesystemen werden als Input verwendet und der Output verglichen… |
| Wissenschaftliche Validität | Allgemeiner Zusammenhang zwischen Output und klinischem Zustand | Literaturrecherche, klinische Studien (prospektiv, longitudinal, retrospektiv…), Post-Market Aktivitäten | Zusammenhangsmaße (Korrelationskoeffizient..), Darstellung des therapeutischen Behandlungserfolgs - verglichen mit Goldstandard | Zusammenhang der automatisierten Analyse von Aufnahmen unter Beleuchtung mit UV- Licht zur Detektion von malignen Hautveränderungen |
| Klinische Leistungsfähigkeit | Ermittlung der (diagnostischen) Leistungsfähigkeit des Output-Parameters | Klinische Studien (Vergleich mit Goldstandard…), Literaturrecherche (Äquivalenzbetrachtung), Post-Market Aktivitäten | Sensitivität, Spezifität, positiv / negativ prädiktiver Wert… | Sensitivität und Spezifität des konkreten SaMDs im Vergleich mit Goldstandard (pathohistologische Untersuchung) |
Zusammenhang Risikopotential - klinischer Evidenzgrad
Abhängig vom Risikopotential wird also nun die Strategie der klinischen Bewertung definiert, wobei bei kritischen Produkten zusätzlich ein unabhängiges Review der klinischen Evidenz verlangt wird.
| Risikokategorie | Strategie der klinischen Bewertung | Beispiel | Unabhängige Überprüfung |
|---|---|---|---|
| I.i - I.ii - I.iii | Allgemein: AV, SV Neuartig: AV, SV, “Real World Experience” | Detektion von Augenbewegungen bei Astigmatismus zur Anleitung der folgenden diagnostischen Schritte (I.i) | Nicht erforderlich |
| II.i - II.iii | Allgemein: AV, SV Neuartig: AV, SV, “Real World Experience” Diagnostisch: AV, SV, CP | Softwaresystem, welche prädiktive Werte hinsichtlich Schlaganfallrisiko generiert um Präventionsstrategien zu entwickeln (II.iii) | Nicht erforderlich |
| II.ii - III - IV | Allgemein: AV, SV Diagnostisch: AV, SV, CP | Softwaregestützte Analyse von Liquorflüssigkeit zur Diagnose von viraler Meningitis bei Kindern (IV.i) | Erforderlich |
Beispiel
Zweckbestimmung: Das SaMD soll histopathologische Untersuchungen von Biopsien ersetzen um automatisiert Zellveränderungen zu detektieren, welche bei malignen Melanomen auftreten. Dazu werden Fotografien softwaregestützt ausgewertet, welche mittels eines speziellen Objektivs unter UV Beleuchtung aufgenommen werden. Da das Krankheitsbild als kritisch einzustufen ist, ist das SaMD in die Kategorie IV.i einzustufen. Daraus ergibt sich folgende Möglichkeit für die Strategie der klinischen Bewertung:
- Analytische Valdität (auszugsweise):
- Literaturrecherche - die beobachteten Hautveränderungen stehen ganz allgemein in Beziehung zur Entwicklung von malignen Melanomen.
- Wiederholbarkeit - Die Bilder des selben Patienten führen zu einem vergleichbaren Output
- Unterer Grenzwert - die kleinste zu detektierende Hautveränderung wird bestimmt
- Wissenschaftliche Validität:
- Literatur und klinische Studien, welche zeigen, dass ein Zusammenhang der automatisierten Analyse von Aufnahmen unter Beleuchtung mit UV- Licht zur Detektion von malignen Hautveränderungen führen kann.
- Klinische Leistungsfähigkeit:
durch eine prospektive Studie wird die Methode mit dem Goldstandard (histopathologische Untersuchungen) verglichen, um die Sensitivität und Spezifität unter verschiedenen Rahmenbedingungen zu erheben (Patientenpopulation, Hauttypen, Kontrastverhälnisse). Um die Anzahl der tatsächlichen Krankheitsfälle zu erfassen, kann es möglich sein, dass die StudienteilnehmerInnen lange nachbeobachtet werden müssen.
- Post-Market Studie: Zusätzlich wird eine Post-Market Studie durchgeführt, um die klinische Leistungsfähigkeit weiter zu beobachten.
Fazit
Das Dokument stellt eine wichtige Informationsquelle für Hersteller von SaMD dar um eine Strategie zur klinischen Bewertung zu erarbeiten. Wichtig zu erwähnen ist, dass diese Rahmenbedingungen die Sichtweise der amerikanischen Zulassungsbehörde darstellen. Für Europa ist das Dokument zwar ebenfalls von Interesse - es sei in Bezug auf die klinische Bewertung allerdings zusätzlich auf das MedDev Guidance Document 2.7/1 rev 4 (MD/AIMD) Blog-Artikel bzw. auf entsprechende Dokumente des IMDRFs (IVD) verwiesen.
Die Strategie der klinischen Bewertung sollte in jedem Fall zu einem frühen Zeitpunkt der Entwicklung erfolgen - durchaus initial bereits nach der Definition der Zweckbestimmung und der entsprechenden Risikoklasse des SaMDs. Eine erste Literaturrecherche kann beispielsweise dazu dienen, um zusätzlich den vorhandenen Wissensstand abzuklären. Basierend auf:
- der Indikation (Diabetes I oder II…),
- der Patientenpopulation (Kinder, Erwachsene, postmenopausale Frauen…),
- der Erfolgsparameter (Sensititivät, Spezifität, Blutdruckabnahme…),
- und Qualität der recherchierten Studien (randomisiert, doppelblind…).
kann so eine erste Einschätzung der klinischen Beweislage geschehen. Die Risikoklasse des SaMDs in Kombination mit dem aktuellen Evidenzgrad bildet weiterführend Grundlage für die Planung der Strategie der klinischen Bewertung - inklusive Studien nach der Markteinführung (um beispielsweise die Patientenpopulation zu erweitern).
Hersteller von SaMDs, welche die Markteinführung in Amerika anstreben, sollten diesen Entwurf unbedingt im Auge behalten.
IEC 62366:2007 vs IEC 62366:2015 - Anwendung der Gebrauchstauglichkeit auf Medizinprodukte
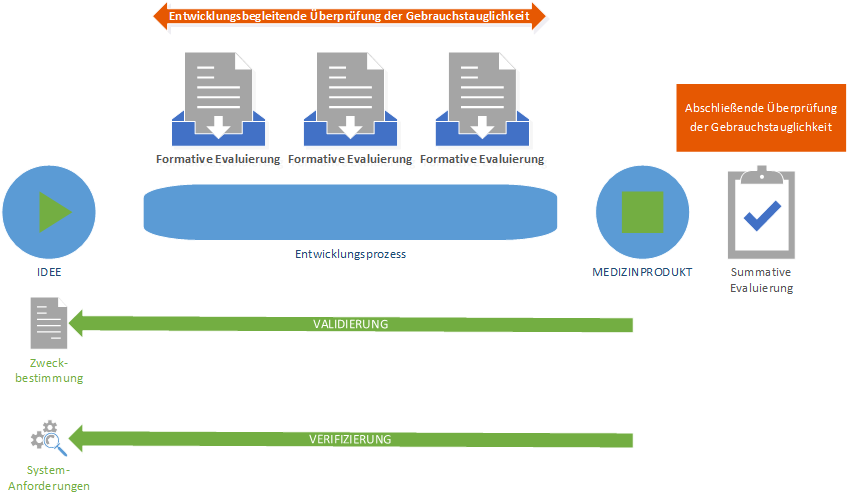
Fehlbedienung eines Medizinproduktes kann schwerwiegende Folgen für Patient, Anwender und Dritte haben. Die Betrachtung der Gebrauchstauglichkeit eines Medizinproduktes muss daher entwicklungsbegleitend passieren und eng mit dem Risikomanagement verbunden werden. Die Norm IEC 62366 fordert einen gebrauchstauglichkeitsorientierten Entwicklungsprozess von Medizinprodukten, um mit der Benutzung verbundene Risiken zu minimieren. Ende 2016 wird die neue Version dieser „Usability-Norm“ harmonisiert werden. Dann wird es eine sogenannte Normenreihe der IEC 62366 geben – IEC 62366-1:2015 & IEC 62366-2:2015.
Bewertung der Gebrauchstauglichkeit
Neu ist, dass bereits während der Entwicklungsphase Evaluierungen der Gebrauchstauglichkeit durchgeführt werden müssen. So „spricht“ die Norm IEC 62366-1:2015 nicht mehr von Verifizierung und Validierung der Gebrauchstauglichkeit, sondern von formativer und summativer Evaluierung der Gebrauchstauglichkeit. Die formative Evaluierung entspricht einer entwicklungsbegleitenden und die summative Evaluierung einer abschließenden Prüfung der Gebrauchstauglichkeit. Die Norm IEC 62366-1:2015 überlässt es dem Medizinprodukte-Hersteller, ob der die formative und summative Evaluierung als Verifizierung oder Validierung vollzieht.
Spezifikation der Gebrauchstauglichkeit
In Bezug auf spezielle Fachausdrücke, welche vor allem für die Spezifikation der Gebrauchstauglichkeit von Wichtigkeit sind, haben in der IEC 62366-1:2015 die sogenannten „Hauptbedienfunktionen“ unleugbar an Bedeutung verloren. Vielmehr sind es nun die auf die Sicherheit bezogenen Merkmale der Benutzungsschnittstelle, auf welche bei der Spezifikation der Gebrauchstauglichkeit der Fokus zu legen ist.
Benutzungsszenarien
Laut IEC 62366-1:2015 genügt es nun nicht mehr, die Benutzungsszenarien nur zu kennen. Sich aus den bekannten Benutzungsszenarien ergebende sicherheitsbezogene Merkmale müssen identifiziert und beschrieben werden. Diese Analyse muss stark mit dem Risikomanagement verbunden und in die Risikoanalyse mitaufgenommen werden.
UOUP (User Interface of Unknown Provenance)
Benutzungsschnittstelle oder ein Teil einer Benutzungsschnittstelle mit unbekanntem Entwicklungsprozess, wird in der Norm IEC 623661:2015 also UOUP definiert. Für den Fall, dass ein Medizinprodukte-Hersteller eine solche Benutzungsschnittstelle zukauft, kann eine verkürzte Betrachtung der Gebrauchstauglichkeit vollzogen werden. Rein die Risiken, die mit der Anwendung des zugekauften Produktes einhergehen müssen betrachtet werden.
Trainings- und Begleitmaterialien
Die IEC 62366:2007 enthielt für Trainings- und Begleitmaterialen noch ein eigenständiges Kapitel. In der IEC 62366-1:2015 hingegen wurde diese Thematik in den normalen Gebrauchstauglichkeits-Prozess integriert.
Harmonisierung der IEC 62366: 2015
Mit der Umsetzung harmonisierter Normen geht auch die Konformität der Medizinprodukte mit den grundlegenden Anforderungen der im europäischen Rechtssystem stehenden europäischen Medizinprodukte Richtlinien einher. Künftig werden diese Richtlinien durch die Medizinprodukte-Verordnung ersetzt werden. Mit der Harmonisierung der IEC 62366:2015 ist mit Ende 2016 zu rechnen.
Praxisseminar Klinische Bewertung
Die klinische Bewertung von Medizinprodukten stellt eine essentielle Tätigkeit während der Produktentwicklung und darüber hinaus dar. Dieses Seminar schafft die Grundlagen zur Bewältigung der wesentlichen Herausforderungen in Hinblick auf die Literaturrecherche bzw. die Durchführung einer klinischen Prüfung.
Ziel der klinischen Bewertung ist die Darstellung der medizinischen Wirksamkeit und der sicherheitsrelevanten Eigenschaften des Medizinprodukts. Beide Aspekte sind in Form eines klinischen Nutzen/Risikoprofils abschließend zu vergleichen.
Dieses Seminar behandelt zwei Methoden, welche für die Recherche von klinischen Daten eingesetzt werden können: die Durchführung einer Literaturrecherche in anerkannten Datenbanken und die Durchführung einer klinischen Prüfung am Menschen. Die theoretischen Fachkenntnisse werden hierbei durch zahlreiche Beispiele aus der Praxis ergänzt. Augenmerk wird zusätzlich darauf gelegt, wie die Aufbereitung und Struktur der Dokumentation der klinischen Bewertung zu erfolgen hat.
- Ort: Fachhochschule Linz, Garnisonstraße 21, 4020 Linz
- Termin: 06. Oktober 2016
- Dauer: 1 Tag , 09:00 – 17:00 Uhr, inklusive Verpflegung
- Kosten: 590 €
- Sprache: Deutsch
- Voraussetzungen: grundlegende Kenntnisse im Bereich der Medizinprodukteentwicklung
- Unterlagen: Deutsch
- Maximale Anzahl: 8 TeilnehmerInnen
- Zielgruppe: Produktmanagement, Qualitätsmanagement, Geschäftsführung, Projektleitung
- Vortragender: DI (FH) Dr. Michael Ring, Geschäftsführer R‘n‘B Consulting GmbH & Studienkoordinator Kepler Universitätsklinikum
- Anmeldung unter office@rnb-consulting.at
MEDDEV 2.7/1 revision 4 - CLINICAL EVALUATION: A GUIDE FOR MANUFACTURERS AND NOTIFIED BODIES
Die Erstellung und Pflege der klinischen Bewertung stellt oftmals eine große Herausforderung für Hersteller von Medizinprodukten dar. Grund hierfür ist, dass diese Tätigkeit eine tiefgehende Produktkenntnis in Kombination mit einem fundierten Methodenwissen im Bereich des wissenschaftlichen Arbeitens erfordert.
Ziel der Aktivität der klinischen Bewertung ist in jedem Fall die Erstellung eines klinischen Risiko/Nutzen-Profils unter Rücksichtnahme der klinischen Wirksamkeit und des Sicherheitsprofils Ihres Medizinprodukts. Im Juni 2016 ist dazu eine aktualisierte Version des entsprechenden MEDDEV Guidance Documents 1) veröffentlicht worden. Dieses Dokument definiert nun deutlich detaillierter die Erwartungen der Behörden und der benannten Stellen an die Tätigkeiten der klinischen Bewertung.
Der Prozess der klinischen Bewertung
Eines vorweg: Der grundsätzliche Ablauf hat sich im Vergleich zu der letzten Version nicht geändert. Nachwievor
- wird die produkt- und anwendungsspezifische Zielsetzung definiert,
- folgen sämtliche Tätigkeiten einem vorher definierten Plan,
- werden klinische Daten gesammelt,
- wird die Relevanz der gefundenen klinischen Daten bewertet,
- werden die relevanten Daten analysiert und zu einem Bericht aufbereitet.
Die klinischen Daten werden als Ergebnis einer Literaturrecherche, einer klinische Prüfung oder aus einer Kombination erfasst - auch dieser Punkt stellt keine wesentliche Neuerung dar.
Post Market Clinical Follow Up
Die Phase der Marktüberwachung nach der erstmaligen Inverkehrbringung ist bereits in Richtlinien, nationalen Gesetzen und in harmonisierten Normen (EN ISO 14971) verankert. Dennoch wird deutlich, dass dieser Phase im Kontext der klinischen Bewertung deutlich mehr Gewicht zugesprochen wird. Die Häufigkeit dieser Aktualisierungen ist nun beispielsweise klarer definiert. Diese müssen bei Hochrisikoprodukten bzw. bei neuartigen Produkten jährlich und bei Produkten mit niedrigem Risikopotential bzw. bei etablierten Produkten alle 2-5 Jahre durchgeführt werden. Zusätzlich muss eine erneute Überprüfung anlassbezogen erfolgen, beispielsweise nach gemeldeten Vorfällen wie unerwünschten Ereignissen.
Im Zuge dieser Updates müssen inbesondere das Risiko/Nutzen Profil, die Wirksamkeit von Risikokontrollmaßnahmen und die in den Begleitinformationen enthaltenen Behauptungen auf Validität überprüft werden. Sämtliche Tätigkeiten müssen in einem Post Market Clinical Follow Up Plan definiert sein, welcher wiederum fixer Bestandteil der Dokumentation zur klinischen Bewertung sein muss.
Qualifikation der Autoren
Ebenfalls klarer definiert sind nun die erforderlichen Qualifikation der Autoren der klinischen Bewertung. Diese umfassen nun nachgewiesene Kenntnisse im Bereich der klinischen Wissenschaften (Studiendesign, Biostatistik), der medizinischen Anwendung (Krankheitsbild, Alternativtherapien) und der Anwendung (Produktmanagement). Diese Kenntnisse sind oftmals nur durch ein interdisziplinäres Team zu gewährleisten und erfordern ein hohes Maß an Koordination und Kommunikation.
Äquivalenzbetrachtung
Es ist zweifelsohne verlockend, die klinischen Daten von ähnlichen Produkten für die eigene klinische Bewertung heranzuziehen. Die Regeln dafür sind jetzt deutlich klarer festgelegt. Das vergleichbare Produkt muss hinsichtlich der klinischen, technischen und biologischen Eigenschaften ausreichend ähnlich sein.
Klinische Kriterien umfassen auszugsweise:
- eine vergleichbare medizinische Indikation
- eine vergleichbare Zweckbestimmung
- ein vergleichbare Lokalisation der Anwendung
- eine vergleichbare Prüfpopulation (Alter, Geschlecht, anatomische bzw. physiologische Gesichtspunkte…)
Technische Kriterien umfassen auszugsweise:
- ein vergleichbares Design
- vergleichbare Umgebungsbedingungen (Temperatur, Luftfeuchtigkeit, Sterilität, Betriebssystem…)
- eine vergleichbare Spezifikation (Energieintensität, Pulsform, Partikelgröße, Viskosität, Oberflächeneigenschaften…)
Biologische Kriterien umfassen auszugsweise:
- eine Verwendung von vergleichbaren Materialien bzw. Substanzen
Die Herausforderung besteht oftmals in der Definiton dieser Kriterien. Bis zu welchen Grenzen ist beispielsweise mein Produkt technologisch vergleichbar mit einem anderen Produkt? Es kann durchaus sein, dass hierfür einzelne nicht-klinische und klinische Studien durchgeführt werden müssen, um die Vergleichbarkeit mit einem bestehenden Produkt nachzuweisen. Ein konkretes Beispiel dazu kann hier abgerufen werden. In diesem Fall werden u.a. die Leistungsmerkmale eines diagnostischen Produkts mit bestehenden Produkten verglichen.
Die Gewichtung der o.g. Kriterien kann beispielsweise über eine semiquantitative Skala erfolgen - eine technologische Vergleichbarkeit, welche beispielsweise über eine Studie nachgewiesen wurde, kann hierbei mit einer hohen Punktezahl bewertet werden. Ist zusätzlich die klinische Anwendung ausreichend vergleichbar, stehen die Chancen nicht schlecht, dass Sie die klinischen Daten auch für Ihr Produkt heranziehen können.
Zusammenfassung
Die neue Version dieses MEDDEV Guidance Documents definiert viele Punkte klarer und hinterlässt deutlich weniger Interpretationsspielraum. Dieses ist insbesonders in Hinblick auf die Kommunikation mit benannten Stellen und Behörden begrüßenswert. Es ist allerdings auch eine Zunahme der klinischen Prüfungen zu erwarten, beispielsweise wenn es um die Vergleichbarkeit mit bestehenden Produkten geht.
Planung des Software-Lebenszyklus
Nach einer arbeitsbedingten, schöpferischen Pause möchten wir nun wieder voll Durchstarten und in dem aktuellen Blogartikel die Tätigkeit der Planung des Software-Lebenszyklus skizzieren. Nun muss man ehrlicherweise zugeben, dass es in der Praxis im Regelfall aber gerade nicht so ist, dass der erste Schritt die Planung darstellt – vielmehr werden initial oftmals grob die Nutzergruppen und der Nutzungskontext beschrieben um basierend darauf die Komplexität und den Aufwand einschätzen zu können. Ein guter Ausgangspunkt ist hierbei – Sie ahnen es sicher bereits – Ihre Zweckbestimmung. Gut erstellt, dient diese perfekt dazu, Ihre Produktidee zu kommunizieren und dadurch den unterschiedlichen Abteilungen einen ersten Eindruck zu vermitteln. Die Komplexität Ihres Produkts entscheidet auch ganz wesentlich Ihre weitere Vorgehensweise: Entwickeln Sie beispielsweise eine Mobile-Health Applikation, kann eine detaillierte Zweckbestimmung durchaus ausreichen, um eine seriöse Planung und Abschätzung des Lebenszyklus durchzuführen. Ist die Komplexität Ihres Systems allerdings vergleichbar mit der eines PACS Systems, wird eine Planung zum aktuellen Zeitpunkt nur sehr schwierig möglich sein und eine fundiertere Anforderungsanalyse nötig sein.
Pläne, Pläne, Pläne
Eines Vorweg – die Gesamtheit der zu planenden Tätigkeiten werden nur in den seltensten Fällen in einem einzigen Plan realisiert. Diese Trennung ist insofern auch sinnvoll, als dass die einzelnen Pläne von unterschiedlichen Personen für unterschiedliche Zielgruppen geschrieben werden.
Projektmanagementplan
Auf der übergeordneten Ebene des Projektmanagementplans kann es durchaus zielführend sein, die Arbeitspakete und die Meilensteine eher grob zu definieren und das Augenmerk auf die Ressourcenplanung und Einschätzung der Timelines zu legen. Der genaue Entwicklungsprozess beispielsweise muss hier noch nicht im Detail spezifiziert werden. An dieser Stelle ein Tipp aus der Praxis: Achten Sie bei der Festlegung des Freigabezeitpunkts Ihres Medizinprodukts auch immer auf das Marketing. Oftmals gibt es durch jährlich stattfindende Fachkongresse harte Deadlines, bei denen Ihr Produkt vorgestellt werden muss und entsprechend fachgruppenwirksam präsentiert wird.
Software-Entwicklungsplan
Die Inhalte des Software-Entwicklungsplans sind in der IEC 62304 unter 5.1.1 beschrieben – so werden in diesem Plan u.a. die einzelnen Entwicklungsphasen definiert und in einen logischen Zusammenhang gebracht (Lebenszyklusmodell). Die Phase der Erstellung der Spezifikation hat beispielsweise
- als definierten Input ein freigegebenes Lastenheft,
- als Output die nachvollziehbare Spezifikation (mit entsprechenden Referenzen auf das Lastenheft / Nutzeranforderungen),
- als Verifikationstätigkeit den Nachweis, dass Sie einzelnen Anforderungen gewisse Eigenschaften aufweisen (widerspruchsfrei, verständlich, …)
- als Validierungstätigkeit den Nachweis, dass alle Anforderungen aus dem Lastenheft richtig umgesetzt wurden.
Software-Wartungsplan
Dieser wichtige Plan behandelt die Phase(n) nach der erstmaligen Freigabe. Hier sollte definiert sein, welche Kriterien Sie anlegen, um die eingehenden Rückmeldungen zu bewerten und das Problem zu analysieren. Harte Kriterien und eine gute Einschulung Ihres Servicecenters sind hierbei Pflicht, um eine objektive Einschätzung zu erhalten. Ebenso sollte in diesem Plan beschrieben sein, was Sie unter einem Bugfix, Patch, Update oder Service Pack verstehen und ob es definierte Releasezyklen gibt.
Software-Konfigurationsmanagementplan
Dieser Plan dient der eindeutigen Identifikation der erstellten Artefakte – beginnend bei Dokumenten (Spezifikation, Software-Architektur, Testpläne…) bis hin zu den Source-Code Komponenten. Die Festlegung der Dokumentnamen auf Dateiebene, die Bezeichnung der einzelnen Anforderungen, Risiken und Problemberichte und, ganz wichtig, die Organisation Ihres Konfigurationsmanagementsystems (SVN, Git, Mercurial…) runden diesen Plan ab.
Risikomanagementplan
Der Risikomanagementplan beschreibt die essentiellen Tätigkeiten in Hinblick auf die Identifikation, Einschätzung und Kontrolle von Gefährdungen in Zusammenhang mit Ihrem Produkt. Sie erinnern sich bestimmt an den oben erwähnten Software-Entwicklungsplan – es macht absolut Sinn, jeder der beschriebenen Phasen auch entsprechende Tätigkeiten des Risikomanagements (FMEA, …) zuzuordnen.
Planung der Gebrauchstauglichkeit
Gleiches gilt auch für Tätigkeiten in Zusammenhang mit dem Usability-Engineering. Von der Phase der Erstellung der Spezifikation bis hin zum Validieren der Gebrauchstauglichkeit sollte hierbei auf die einzelnen Phasen der Software-Entwicklung, jeweils im Kontext der Risikomanagementaktivitäten, eingangen werden (z.B. erste Definition der vorhersehbaren Fehlbedienung basierend auf den initialen Nutzeranforderungen in der Phase der Anforderungsanalyse).
Planung der klinischen Bewertung
Besonders bei innovativen Produkten ist es sinnvoll, sich ehestmöglich einen ersten Überblick über die vorhandenen klinischen Daten zu machen. Recherchieren Sie basierend auf der Zweckbestimmung in gängigen medizinischen Datenbanken 2) nach Leistungs- und Sicherheitsdaten zu Ihrem Medizinprodukt bzw. äquivalenten Produkten. Ziel dieser Aktivität ist es festzustellen,
- ob Sie zusätzlich klinische Prüfungen am Menschen benötigen, um klinische Daten mit Ihrem Produkt zu erheben,
- ob Sie zusätzlich klinische Prüfungen am Menschen benötigen, um die Äquivalenz mit einem bereits existierenden Produkt nachzuweisen,
- welchen Weg Sie in Bezug auf präklinische Prüfungen, z.B.: bei der Bewertung der Biokompatibilität, gehen müssen.
Erst nach dieser Tätigkeit wird es möglich sein, eine seriöse Planung und Kostenabschätzung der klinischen Bewertung durchzuführen.
Verantwortlichkeiten
Auf der Ebene des Projektmanagementplans ist es wichtig, die Definition der Verantwortlichkeiten, zumindest auf Abteilungsebene, durchzuführen. Dies ist letztendlich auch nötig, um eine seriöse Abschätzung des abteilungsspezifischen und gesamten Finanzierungsbedarfs erstellen zu können. Die detaillierte Definition von Verantwortlichkeiten auf Ebene der einzelnen Positionen ist zielführend in den anderen, untergeordneten Plänen. Beispielsweise bietet sich für die Festlegung dafür die RASCI 3)Methode an.
So weit ein kurzer Einblick in diese herausfordernden Tätigkeiten. Wie eingangs erwähnt, bleibt die Organisation dieser Pläne Ihnen überlassen - fassen Sie je nach Sinnhaftigkeit die einzelnen Pläne zusammen oder referenzieren Sie die einzelnen Pläne untereinander. Im nächsten Blogartikel werden wir auf unterschiedliche Lebenszyklusmodelle für medizinische Software eingehen und gleichzeitig die Phase der Planung abschließen.
<< Newer entries | Older entries >>