Table of Contents
IEC 62366:2007 vs IEC 62366:2015 - Anwendung der Gebrauchstauglichkeit auf Medizinprodukte
Fehlbedienung eines Medizinproduktes kann schwerwiegende Folgen für Patient, Anwender und Dritte haben. Die Betrachtung der Gebrauchstauglichkeit eines Medizinproduktes muss daher entwicklungsbegleitend passieren und eng mit dem Risikomanagement verbunden werden. Die Norm IEC 62366 fordert einen gebrauchstauglichkeitsorientierten Entwicklungsprozess von Medizinprodukten, um mit der Benutzung verbundene Risiken zu minimieren. Ende 2016 wird die neue Version dieser „Usability-Norm“ harmonisiert werden. Dann wird es eine sogenannte Normenreihe der IEC 62366 geben – IEC 62366-1:2015 & IEC 62366-2:2015.
Bewertung der Gebrauchstauglichkeit
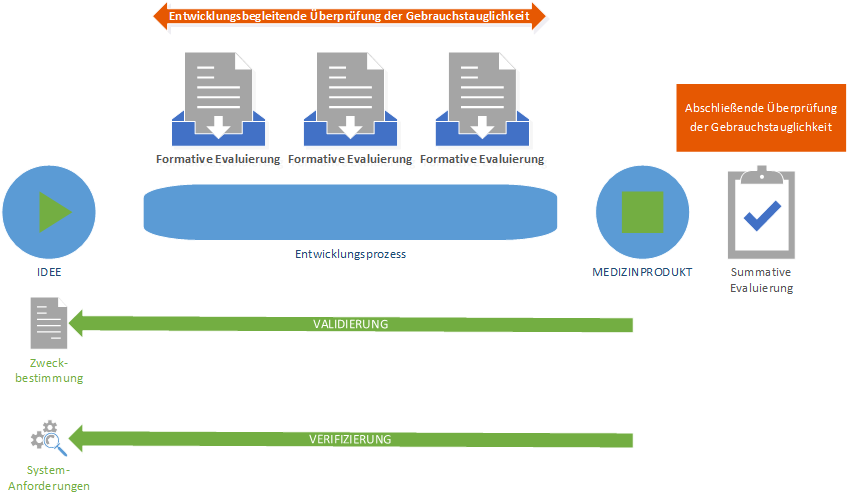
Neu ist, dass bereits während der Entwicklungsphase Evaluierungen der Gebrauchstauglichkeit durchgeführt werden müssen. So „spricht“ die Norm IEC 62366-1:2015 nicht mehr von Verifizierung und Validierung der Gebrauchstauglichkeit, sondern von formativer und summativer Evaluierung der Gebrauchstauglichkeit. Die formative Evaluierung entspricht einer entwicklungsbegleitenden und die summative Evaluierung einer abschließenden Prüfung der Gebrauchstauglichkeit. Die Norm IEC 62366-1:2015 überlässt es dem Medizinprodukte-Hersteller, ob der die formative und summative Evaluierung als Verifizierung oder Validierung vollzieht.
Spezifikation der Gebrauchstauglichkeit
In Bezug auf spezielle Fachausdrücke, welche vor allem für die Spezifikation der Gebrauchstauglichkeit von Wichtigkeit sind, haben in der IEC 62366-1:2015 die sogenannten „Hauptbedienfunktionen“ unleugbar an Bedeutung verloren. Vielmehr sind es nun die auf die Sicherheit bezogenen Merkmale der Benutzungsschnittstelle, auf welche bei der Spezifikation der Gebrauchstauglichkeit der Fokus zu legen ist.
Benutzungsszenarien
Laut IEC 62366-1:2015 genügt es nun nicht mehr, die Benutzungsszenarien nur zu kennen. Sich aus den bekannten Benutzungsszenarien ergebende sicherheitsbezogene Merkmale müssen identifiziert und beschrieben werden. Diese Analyse muss stark mit dem Risikomanagement verbunden und in die Risikoanalyse mitaufgenommen werden.
UOUP (User Interface of Unknown Provenance)
Benutzungsschnittstelle oder ein Teil einer Benutzungsschnittstelle mit unbekanntem Entwicklungsprozess, wird in der Norm IEC 623661:2015 also UOUP definiert. Für den Fall, dass ein Medizinprodukte-Hersteller eine solche Benutzungsschnittstelle zukauft, kann eine verkürzte Betrachtung der Gebrauchstauglichkeit vollzogen werden. Rein die Risiken, die mit der Anwendung des zugekauften Produktes einhergehen müssen betrachtet werden.
Trainings- und Begleitmaterialien
Die IEC 62366:2007 enthielt für Trainings- und Begleitmaterialen noch ein eigenständiges Kapitel. In der IEC 62366-1:2015 hingegen wurde diese Thematik in den normalen Gebrauchstauglichkeits-Prozess integriert.
Harmonisierung der IEC 62366: 2015
Mit der Umsetzung harmonisierter Normen geht auch die Konformität der Medizinprodukte mit den grundlegenden Anforderungen der im europäischen Rechtssystem stehenden europäischen Medizinprodukte Richtlinien einher. Künftig werden diese Richtlinien durch die Medizinprodukte-Verordnung ersetzt werden. Mit der Harmonisierung der IEC 62366:2015 ist mit Ende 2016 zu rechnen.