Neuigkeiten
Neuigkeiten
! Medizinprodukteberater-Schulung via RnB - Regulatory & Beyond, your trusted navigator in regulatory challenges !
🚑 Medizinprodukte am Markt – aber nur mit geschultem Team! 💪 Schon gewusst?
Wer Medizinprodukten in Verkehr bringt oder auf dem Markt bereitstellt, ist verpflichtet MitarbeiterInnen als MedizinprodukteberaterInnen zu schulen!
👉 Das betrifft nicht nur den Außendienst, sondern alle, die in irgendeiner Form KundInnen oder AnwenderInnen beraten – sei es im Vertrieb, Service, Hotline oder Produktmanagement.
👉 Ziel: Sichere Anwendung, korrekte Beratung und volle Rechtssicherheit für Unternehmen.
Wir von RnB Consulting GmbH unterstützen dabei mit:
✅ Praxisnahen Schulungen für Medizinprodukteberater:innen
✅ Rechtlich fundierten Inhalten (MPG & MDR)
✅ Dokumentiertem Schulungsnachweis für Ihre Compliance
Damit Sie und Ihr Team sicher aufgestellt sind – für KundIinnen, PatientInnen und Behörden.
📩 Kontaktieren Sie uns gerne, wenn Sie Ihre MitarbeiterInnen fit für die Rolle als MedizinprodukteberaterIn machen wollen!! Neue RnB-Kooperationspartner !
🔗 Neue Partnerschaft: R'n'B Consulting GmbH + OFI Österreichisches Forschungsinstitut für Chemie und Technik – Gemeinsam für sichere Medizinprodukte!
Wir freuen uns sehr, unsere neue Kooperation mit OFI bekanntzugeben!
🏥 RnB unterstützt Medizinprodukte-Hersteller bei allen Themen rund um MDR-Compliance – von der strategischen Beratung bis zur praktischen Umsetzung.
🧪 OFI ist Spezialist für Biokompatibilitätsprüfungen und bringt jahrzehntelange Laborkompetenz und Erfahrung mit internationalen Standards ein.
💡 Das bedeutet für Medizinprodukte-Hersteller:Sicherheit, Effizienz und alles aus einer Hand.
Fragen dazu? Gerne unter office@rnb-consulting.at
! Wir erweitern unser Netzwerk !
Wir liefern die “one-stop-Lösung”
Alles aus einer Hand durch unseren Support!
Wir bieten nun auch die Kooperation mit Experten zum Thema Klinische Prüfungen + Klinische Studien mit speziellem Scope an!
Daher unbedingt den 25.04.2025 vormerken, da wird's ein - natürlich kostenloses - Remote-Kennenlern-Meeting für alle Interessenten geben! 🤝💼 Um den Veranstaltungslink zu erhalten, ersuchen wir um Anmeldung via office@rnb-consulting.at
AAL meets Digital.Health Veranstaltung am 12.12.2023
AAL meets Digital.Health
Am 12. Dezember ist R'n'B Consulting bei der AAL Praxiskonferenz “AAL meets Digital.Health” in Linz!
Die Veranstaltung widmet sich den Themen “Design4all”, “Digitale Gesundheitsanwendungen (DiGA)” und “Medizinische Datenbeschaffung”. Ziel ist die Vernetzung von Wirtschaft, Sozialem und Forschung im Bereich Digital Health.
Wir freuen uns auf spannende Einblicke und neue Kontakte! 🎉
📍 Wo? Johannes Kepler Universität
⏰Wann? 12.12.2023 09:00 - 17:00
Veranstalter: MTC, AAL, JKU
Nähere Informationen Zur AnmeldungUpdate - Benannte Stellen
Anzahl der akkreditierten Stellen
Die 40. Benannte Stelle - für die Medizinprodukte-Verordnung (EU) 2017/745 (MDR) - ist nun auf der NANDO Datenbank der Europäischen Kommission gelistet. Mit den aktuell 12 Benannten Stellen, die für die IVD-Verordnung (EU) 2017/746 gelistet sind, stehen nun gesamt 52 Benannte Stellen für die Konformitätsbewertung und Zertifizierung - basierend auf EU-Regularien für Medizinprodukte zur Verfügung.
Benannte Stellen MDR Benannte Stellen IVDRLISAvienna Regulatory Konferenz
Wir waren dort!
🌟 R'n'B Consulting auf der LISAvienna Regulatory Konferenz am 17.10.2023! 🌟
Die zentrale Veranstaltung für MDR und IVDR im Schönbrunner Apothekertrakt bot einen intensiven Austausch zu aktuellen Entwicklungen, Herausforderungen und rechtlichen Rahmenbedingungen bei der Marktzulassung von Medizinprodukten und In-vitro Diagnostika an.
Wir sind dankbar, Teil dieser dynamischen Branche zu sein, auf Veranstaltungen wie dieser wertvolle Einblicke zu gewinnen und Kontakte zu knüpfen. 🤝💼HALLOWEEN SPECIAL
10% NACHLASS
10% Nachlass bei Beauftragung bis ENDE OKTOBER auf unser Startup-Support-Package & unsere RnB-Workshops! 🚀
Verpassen Sie diese Gelegenheit nicht & Kontaktiere Sie uns jetzt! 🎃👉 KONTAKTFORMULAR
Startup-Support-Package
WorkshopsUpcoming Events
08.11.2023 MTC Veranstaltung Regularien - Klar | text (für MTC Partner kostenlos).
Die Veranstaltung behandelt wichtige Themen wie die Intelligenz von KI in der Medizintechnik, die MDR/IVDR-Übergangsfristen, funktionale Sicherheit in der Produktentwicklung, sowie Erfahrungen aus klinischen Bewertungsaudits und die Umsetzung ausgelagerter Herstellungsprozesse. Wir als R'n'B Consulting werden ebenfalls an der Veranstaltung teilnehmen und uns über die neuesten Themen informieren.
MTC Veranstaltung
13-16.11.2023 MEDICA Düsseldorf
Die MEDICA ist eine jährliche Veranstaltung in Düsseldorf, die weltweit als eine der bedeutendsten Messen im Bereich der Medizintechnik und Gesundheitsversorgung gilt. Sie zieht Fachleute und Unternehmen aus der ganzen Welt an, um die neuesten Innovationen und Technologien in der Medizinbranche zu präsentieren und zu erkunden.
MEDICA DüsseldorfNeuer Blog-Post!
FDA-Zulassung für Medizinprodukte: Der anspruchsvolle Tanz durch den regulatorischen Dschungel
Die Zulassung von Medizinprodukten durch die US-amerikanische Food and Drug Administration (FDA) ist ein komplexer Prozess, der verschiedene Herausforderungen und Hürden mit sich bringt. In unserem neuen Blog-Post finden Sie die wichtigsten Punkte, die bei der FDA-Zulassung von Medizinprodukten berücksichtigt werden müssen.
Lesen Sie weiter in unserem neuen Blog Beitrag: Zum Blog
Erweiterung "Manual on borderline and classification for medical devices" - September 2023
Abgrenzung zwischen Medizinprodukten und anderen Arten von Produkten
Das Dokument “Manual on borderline and classification for medical devices” wurde erweitert. Das Dokument gibt Auskunft über spezielle Grenzfälle, bei denen nicht von vornherein klar ist, ob ein bestimmtes Produkt ein Medizinprodukt oder ein In-vitro-Diagnostikum (IVD) ist oder nicht.
Link zum Dokument: Manual on borderline and classification for medical devicesUpdate - Benannte Stellen
Anzahl der akkredidierten Stellen
Die 39. Benannte Stelle - für die Medizinprodukte-Verordnung (EU) 2017/745 (MDR) - ist nun auf der NANDO Datenbank der Europäischen Kommission gelistet. Mit den aktuell 11 Benannten Stellen, die für die In-Vitro-Verordnung (EU) 2017/746 gelistet sind, stehen nun gesamt 50 Benannte Stellen für die Konformitätsbewertung und Zertifizierung - basierend auf EU-Regularien für Medizinprodukte zur Verfügung.
Benannte Stellen MDR Benannte Stellen IVDRMDR und IVDR Umfrage
EU-Kommission
Die Europäische Kommission hat eine neue Online-Umfrage ins Leben gerufen, deren Hauptziel darin besteht, ein besseres Verständnis für den Informationsbedarf im Zusammenhang mit den Verordnungen zu gewinnen. Dabei liegt der Fokus insbesondere auf der Untersuchung, wie sich die Änderungen in den Rechtsvorschriften auf die unmittelbar beteiligten Akteure auswirken und welche Herausforderungen diese bewältigen müssen, um einen reibungslosen Übergang sicherzustellen. Link zur Umfrage: Zur Umfrage
Veröffentlichung FlowChart
EU-Kommission
Die EU-Kommission hat ein extrem hilfreiches FlowChart veröffentlicht. Dieses soll helfen festzustellen, ob Ihre #medicaldevices unter die #EUMDR Verlängerung vom 20. März 2023 fallen FowChart
Medizin& Technik - Wie KI in der Medizin korrekt aber schneller verfügbar ist
KI in der Medizin
Bevor ein Medizinprodukt auf den Markt kommen kann, müssen viele Details in Betracht gezogen werden, wie Gesetze, Normen, Guidances und der Stand der Technik. Besonders unübersichtlich ist derzeit die Lage für KI-basierte Produkte. Dr. Thorsten Prinz, ein Experte für VDE-Software, erklärt, wie das Konzept “Boost AI to Market” (BAIM) helfen kann. Beitrag Medizin&Technik
Neuer Blog-Post!
Entwicklung nach EU 2017/745 führt zu einer erhöhten Patientensicherheit
Warum ist der Usability-Prozess für Medizinprodukte so wichtig?
Die Entwicklung nach der MDR bietet einen klaren Weg, um die Sicherheit und das Wohlergehen der Patienten zu gewährleisten und die Qualität der medizinischen Versorgung insgesamt zu verbessern. Die MDR stärkt das Vertrauen in Medizinprodukte und fördert die Patientensicherheit, indem sie sicherstellt, dass Produkte den höchsten Standards entsprechen und sorgfältig überwacht werden.
Lesen Sie weiter in unserem neuen Blog Beitrag: Zum Blog
MDReady!
Mit unserer Unterstützung werden Sie MDReady!
Wir stehen gerne Medizinprodukteherstellern zur Seite, um bei der Umsetzung der MDR zu helfen. Vertrauen Sie auf unsere Expertise und machen Sie Ihre Medizinprodukte fit für die Zukunft.

Neuer Blog-Post!
Usability für Medizinprodukte & IVDs
Warum ist der Usability-Prozess für Medizinprodukte so wichtig?
Ein gut durchgeführter Usability-Prozess führt zu einer verringerten Fehleranfälligkeit, reduziertem Schulungsbedarf und erhöhter Kundenakzeptanz und -zufriedenheit. Er verbessert die Sicherheit, Effektivität und Benutzerfreundlichkeit von Medizinprodukten und trägt zur Qualitätsverbesserung der Gesundheitsversorgung bei.
Lesen Sie weiter in unserem neuen Blog Beitrag: Zum Blog
Start-up-Support Package - Jetzt noch schnell anmelden! 30.06.2023 14:00-14:30
Keinen Plan WIE, oder gar OB für eure Start-Up-Produktidee das regulatorische Rahmenwerk der Medizintechnik-Branche einzuhalten ist?
Kein Problem! Am 30.06.23, 14:00 - 14:30 stellen wir euch - remote - unser Startup-Support-Package vor.
Schnell noch anmelden via Kontaktformular, um den Zugangslink zu erhalten:
Anmeldung
Support Technische Dokumentation von IVD
Die Erstellung der Technischen Dokumentation für In-vitro-Diagnostika erfordert sorgfältige Schritte und genaue Kenntnisse der regulatorischen Anforderungen gemäß der IVDR (In-vitro-Diagnostika Verordnung). Ein guter Support in diesem Prozess ist entscheidend, um sicherzustellen, dass alle erforderlichen Informationen korrekt dokumentiert werden.
Die ersten Schritte:
1) Prüfung ob es sich um ein In-vitro-Diagnostikum gemäß Artikel 2 IVDR handelt
2) Aufbau der Zweckbestimmung des In-vitro-Diagnostikums (Anhang I Kapitel III 20.4.1 IVDR)
3) Klassifizierung gemäß Anhang XIII IVDR (Klasse A-D)
Der erste Schritt besteht darin, zu überprüfen, ob das Produkt tatsächlich als In-vitro-Diagnostikum gemäß Artikel 2 Punkt 2 der IVDR gilt. Dieser Artikel enthält eine Definition und Abgrenzung von In-vitro-Diagnostika. Es ist wichtig, sicherzustellen, dass das Produkt alle relevanten Merkmale erfüllt, um als In-vitro-Diagnostikum eingestuft zu werden.
Nachdem die Zweckbestimmung festgelegt ist, ist es notwendig, das In-vitro-Diagnostikum gemäß Anhang XIII Punkt 2 der IVDR zu klassifizieren. Die Klassifizierung erfolgt anhand verschiedener Kriterien wie dem Risiko für den Patienten, der invasiven Natur des Diagnostikums und der Zweckbestimmung. Die Klassifizierung erfolgt in die Klassen A, B, C oder D, wobei Klasse D das höchste Risiko darstellt.
Ein qualifizierter Support bei der Erstellung der Technischen Dokumentation von In-vitro-Diagnostika kann Ihnen helfen, diese Schritte sorgfältig und effektiv durchzuführen. Gerne können wir Ihnen bei Ihrem IVD Produkten helfen, die richtigen Informationen zu erfassen, die relevanten Vorschriften einzuhalten und eine vollständige Technische Dokumentation gemäß den gesetzlichen Anforderungen zu erstellen.
Kontakt
Start-up-Support Package - 30.06.2023 14:00-14:30
Na ⁉
Keinen Plan WIE, oder gar OB für eure Start-Up-Produktidee das regulatorische Rahmenwerk der Medizintechnik-Branche einzuhalten ist?
Kein Problem! Am 30.06.23, 14:00 - 14:30 stellen wir euch - remote - unser Startup-Support-Package vor.
Wir bitten um Anmeldung via Kontaktformular, um den Zugangslink zu erhalten:
Anmeldung
Sie sind ein Start-up-Unternehmen - neu in der MedTech-Branche? Unser Start-up-Support Package unterstützt Sie auf Ihrem Weg!
Alle Informationen zu unserem Package haben wir für Sie am 30.06.2023
Seien Sie dabei bei unserem online Event und entdecken Sie unser Start-up Package und dessen wertvollen Inhalte! Informationen zur Anmeldung folgen.
Start-up Package

Leitlinien der Kommission zu Inhalt und Struktur der Zusammenfassung des Berichts über die klinische Prüfung
Struktur und Zusammenfassung - Bericht über die klinische Prüfung
Das Ziel dieser Leitlinien besteht darin, sicherzustellen, dass die Zusammenfassung des Berichts über die klinische Prüfung alle relevanten Informationen zur Konzeption, Durchführung, Analyse und den Ergebnissen der klinischen Prüfung in einer Sprache und einem Format präsentiert, das leicht verständlich ist für die Anwender des Medizinprodukts.
Die Mindestanforderungen für den Bericht über die klinische Prüfung ist in Anhang XV Kapitel III Abschnitt 7 MDR verankert.
Zur Leitlinie7. Kepler Science Day am 11.05.2023
Tauchen Sie ein in die Welt der Forschung und Innovation auf dem 7. Kepler Science Day!
Freuen Sie sich auf inspirierende Vorträge zu aktuellen Themen wie Medizintechnik, Digitale Transformation, Versorgungs- und Altersforschung sowie faszinierende Einblicke in spannende Dissertationen.
Wann? 11.05.2023; 09:10 - 17:00 Uhr
Wo? MED Campus I (Krankenhausstraße 5, 4020 Linz)
Seien Sie besonders gespannt auf den Vortrag von Herrn Dr. Matthias Gmeiner mit dem Titel “Medical Education in Surgical Aneurysm Clipping (MEDUSA) - A mixed reality solution”. Hier erfahren Sie, wie durch den Einsatz von Mixed-Reality-Technologie ein innovatives und effektives Trainingskonzept für die Chirurgie entwickelt wurde. Lassen Sie sich von diesem faszinierenden Ansatz begeistern und erfahren Sie, wie die Zukunft der medizinischen Ausbildung aussehen könnte!
Veranstaltet von: Medizinischen Fakultät der Johannes Kepler Universität Linz (JKU), dem Kepler Universitätsklinikum (KUK), der FH Oberösterreich (FH OÖ), der FH Gesundheitsberufe OÖ (FHG OÖ), der Upper Austrian Research (UAR) und dem Medizintechnik-Cluster (MTC).
ProgrammübersichtRnB Workshops
Freuen Sie sich auf spannende und vor allem individuell auf Ihre Bedürfnisse angepasste Workshoptage!
Was wir NICHT wollen:
• Frontalvorträge
• Theoretische Erklärungen
• Keinen Mehrwert für Sie und Ihr Unternehmen
Was wir WOLLEN:
• Spezifische Workshops - angepasst an Sie, Ihr Unternehmen, Ihr(e) Medizinprodukt(e)
• Beispiele aus der Praxis
• Ihnen einen Fahrplan und bereits erste Dokumentenentwürfe für Ihre Umsetzungen mit auf den Weg geben
Unsere Themen im Überblick:
• Risikomanagement
• Usability Engineering
• Klinische Bewertung / Klinische Prüfung
• MDR-Umsetzung
• IVDR-Umsetzung
• Software-Entwicklung
• Projektmanagement
• Qualitätsmanagement
• Produktentwicklung
• Post Market Surveillance
Unsere Workshops – individuell an Sie angepasst: Nach einem kurzen Ein- und Überblick über das aktuell geltende regulatorische Rahmenwerk der Medizintechnik, gehen wir gemeinsam auf Praxisbeispiele und Erfahrungen Ihrerseits ein. Den größten Part des Workshops umfasst neben der Erläuterung, wie Sie geforderte Dokumentationen umsetzen, die Erstellung eines für Sie angepassten „Fahrplans“. Dieser bringt Ihnen einen großen Mehrwert, da Sie damit nach dem RnB-Workshop gut ausgerüstet sind, um den regulatorischen Anforderungen für Ihr(e) Medizinprodukt(e) gerecht zu werden.
Sie haben Fragen rund um unsere RnB-Workshops? Kontaktieren Sie uns unter: office@rnb-consulting.at

Sie haben Probleme die korrekten Begrifflichkeiten/Definitionen für Ihre technische Dokumentation zu verwenden?
 Wir haben eine äußerst hilfreiche Gegenüberstellung von DE VS EN Begrifflichkeiten für Sie erstellt!
Wir haben eine äußerst hilfreiche Gegenüberstellung von DE VS EN Begrifflichkeiten für Sie erstellt!
Die Medizinprodukte und In vitro Diagnostika Begriffsübersetzungen sind leider oft nicht einheitlich gewählt und anders übersetzt als im „Sprachgebrauch“ verwendet. Dies erschwert die Suche nach der richtigen Übersetzung eines Begriffes. Besonders hilfreich wird unsere Gegenüberstellung, wenn Sie als Hersteller ursprünglich die Technische Dokumentation in Deutsch erstellt haben, jedoch die Technische Dokumentation bei der Einreichung von Benannten Stellen in Englisch gefordert wird.
Wir bieten Ihnen eine innovative Lösung, um Ihnen die Arbeit hinsichtlich der Übersetzung der Technischen Dokumentation zu erleichtern. Unser spezielles Template stellt die englischen und deutschen Begriffsdefinitionen unterschiedlicher regulatorischer Rahmenbedingungen, wie bspw. MDR, IVDR, und Normen hinsichtlich der Themenbereiche Risikomanagement, Usability Engineering, Software-Entwicklung und Qualitätsmanagement gegenüber.
Mit unserem Dokument sparen Sie wertvolle Zeit und können sich auf die Umsetzung der MDR/IVDR konzentrieren.
Kontaktieren Sie uns jetzt und erleichtern Sie sich den Weg zur Umsetzung der MDR und IVDR!Save the Date: Q&A Day 18.04.2023
In einer Woche ist es so weit! - Unser RnB Q&A Day steht in den Startlöchern
Unser Q&A-Tag ist die perfekte Gelegenheit, sich mit unseren Beratern kostenlos zu verbinden und Ihre brennenden Fragen rund um Ihr Medizinprodukt zu stellen. Nutzen Sie diese Chance, um Ihre Kenntnisse zu erweitern und wertvolle Antworten und Informationen zu erhalten.
Stellen Sie uns Fragen zur Abgrenzung eines Medizinproduktes, Konformitätsbewertungsverfahren oder zur Umsetzung der MDR und IVDR - wir haben die Antworten.
Wie kann ich Fragen stellen? Ganz einfach! Per Email am 18.04.23 an: office@rnb-consulting.at oder über unser Kontakt-Formular: Link
Lassen Sie uns gemeinsam Antworten finden!
Rahmenbedingungen: Um Ihnen möglichst rasch Rückmeldungen geben zu können, bitten wir um Übermittlung von maximal 3 Fragen pro Unternehmen. Lediglich am 18.04 übermittelte Fragen, werden kostenlos bearbeitet

R'n'B Consulting wünscht Frohe Ostern!
R'n'B Consulting GmbH wünscht schöne Osterfeiertage im Kreise der Liebsten!

FDA Entwurf Veröffentlichung - 03.04.2023
FDA Entwurf
Marketing Einreichungsempfehlungen für einen festgelegten Änderungskontrollplan für Geräte mit künstlicher Intelligenz/Maschinellem Learning (AI/ML)-fähiges DSF (Device Software Function)
Mehr Informationen finden Sie im Dokument: Entwurf - FDA
Q&A zu praktischen Aspekten im Zusammenhang mit der neuen Verordnung (EU) 2023/607
Q&A
Das Q&A-Dokument soll die Anwendung der Verordnung (EU) 2023/607 des Europäischen Parlaments und des Rates vom 15. März 2023 zur Änderung der Verordnungen (EU) 2017/745 (MDR) und (EU) 2017/746 (IVDR) in Bezug auf die Übergangsbestimmungen für bestimmte Medizinprodukte und In-vitro-Diagnostika erleichtern.
Mehr Informationen finden Sie im Dokument: Q&A VO (EU) 2023/607
Questions & Answers Day - RnB Consulting!
Q&A Day 18.04.2023
Am 18. April gibt das RnB Expertenteam Ihnen kostenlos die Antworten, die Sie suchen.
Unser Motto für diesen Tag lautet: “Fragen stellen, Wissen teilen - gemeinsam erfolgreich sein!”
Wir glauben, dass der Austausch von Wissen und Erfahrungen der Schlüssel zum Erfolg ist.
Unser Q&A-Tag ist die perfekte Gelegenheit, sich mit unseren Beratern zu verbinden und Ihre brennenden Fragen rund um Ihr Medizinprodukt zu stellen. Nutzen Sie diese Chance, um Ihre Kenntnisse zu erweitern und wertvolle Antworten und Informationen zu erhalten.
Stellen Sie uns Fragen zur Abgrenzung eines Medizinproduktes, Konformitätsbewertungsverfahren oder zur Umsetzung der MDR und IVDR - wir haben die Antworten.
Wie kann ich Fragen stellen? Ganz einfach! Per Email am 18.04.23 an: office@rnb-consulting.at
Safe the Date & Lassen Sie uns gemeinsam Antworten finden!
Rahmenbedingungen: Um Ihnen möglichst rasch Rückmeldungen geben zu können, bitten wir um Übermittlung von maximal 3 Fragen. Lediglich am 18.04 übermittelte Fragen, werden kostenlos bearbeitet.Änderung der Verordnungen (EU) 2017/745 und (EU) 2017/746
Änderung der Übergangsbestimmungen für bestimmte Medizinprodukte und In-vitro-Diagnostika und der Abverkaufsfrist
Die neue Verordnung (EU) 2023/607 verlängert die Übergangsfristen für Medizinprodukte und In vitro Diagnostika (mit bestimmten Bedingungen) und streicht die “Abverkaufsfrist”, nach der Produkte, die vor oder während der Übergangsfristen in Verkehr gebracht wurden und sich noch in der Lieferkette befinden, vom Markt genommen werden mussten.
Link zur Verordnung: VO (EU) 2023/607
Checkliste für MDR/IVDR Codes inklusive Benannte Stellen
Brauchen Sie einen schnellen Überblick über die MDR und IVDR Codes?
Keine Sorge, wir haben genau das Richtige für Sie!
Mit unserer neuen Checkliste können Sie auf einen Blick sehen, welche Benannten Stellen in Ihrer Nähe welche MDR/IVDR Codes behandeln.
Warum ist das so wichtig?
Wenn ein Code außerhalb der genehmigten Codes einer Benannten Stelle liegt, können Sie bei dieser Benannten Stelle kein Konformitätsbewertungsverfahren für Ihr Produkt durchführen und der Antrag wird abgelehnt. Unsere Checkliste zeigt Ihnen auch, wie viele MDR/IVDR Codes pro Kategorie zugewiesen werden müssen, um Antragsänderungen zu minimieren. Mit dem Code-System stellt die Benannte Stelle sicher, dass das Team das erforderliche Fachwissen und Know-how besitzt, um Ihr Produkt optimal zu bewerten.
Haben Sie Interesse an unserer Checkliste? Schreiben Sie uns einfach unter office@rnb-consulting.at
Nähere Informationen zu den MDR/IVDR Codes finden Sie in den MDCG Leitfäden:
MDCG MDR Codes
MDCG IVDR CodesVerlängerung der Übergangsfristen - Verordnung (EU) 2017/745 (MDR)
Zustimmung des Europäischen Rates
Der Europäische Rat hat am 07. März 2023 den Vorschlag zur Verlängerung der Übergangsfristen für Produkte, welche nach der Verordnung (EU) 2017/745 (MDR) eine Benannte Stelle für die Konformitätsbewertung benötigen, offiziell zugestimmt.
Die Verlängerung ist jedoch an bestimmte Bedingungen geknüpft. Mehr Zeit wird nur für Produkte eingeräumt, die sicher sind und für die die Hersteller bereits Maßnahmen zur Umsetzung der MDR unternommen haben.
Für Medizinprodukte mit einem Zertifikat oder einer Konformitätserklärung, die vor dem 26. Mai 2021 ausgestellt wurden, wird die Übergangsfrist wie folgt verlängert:
• Maßgefertigte implantierbare Produkte der Klasse III: bis zum 26. Mai 2026.
• Produkte der Klasse III und implantierbare Produkte der Klasse IIb [mit Ausnahmen]: bis 31. Dezember 2027.
• Andere Produkte der Klasse IIb, Produkte der Klasse IIa und Produkte der Klassen ls, lm, lr.: bis zum 31. Dezember 2028.
Der nächste offizielle Schritt ist die Unterzeichnung und anschließende Veröffentlichung im Amtsblatt.
Nähere Informationen finden Sie in den Dokumenten:
Vorschlag für Änderung der Verordnung
Entwurf des VerordnungstextesNeue Guideline für die Technische Dokumentation von In-vitro-Diagnostika!
Best Practice Guideline
Von den IVD-Herstellern aller Klassen wird erwartet, dass Sie die Konformität des IVDs mit den allgemeinen Sicherheits- und Leistungsanforderungen der IVDR nachweisen, indem Sie eine Technische Dokumentation erstellen und aufbewahren, aus der hervorgeht, wie jedes IVD entwickelt, ausgelegt und hergestellt wurde. Dieser Leitfaden von Mitgliedern des Teams NB legt einen einheitlichen Ansatz für die Einreichung der Technischen Dokumentation dar.
Link zur IVDR Guideline: Best Practice Guideline - Technical Documentation IVDR
Auch für Medizinprodukte gibt es bereits einen Leitfaden für die Technische Dokumentation veröffentlicht von Team-NB:
Best Practice Guideline - Technical Documentation MDRMTC Beitrag RnB Workshops
RnB-Workshops – maßgeschneidert an Ihre medizintechnische Produktpalette
Den regulatorischen Anforderungen für Ihr Medizinprodukt gerecht werden und die dafür notwendigen Dokumente gemeinsam realisieren, das ist oberstes Ziel unserer Workshops!
Im MTC Beitrag finden Sie Informationen über
* den Ablauf der Workshops
* Was wir nicht wollen
* Was wir wollen
* die RnB Workshop Themen
Finden Sie heraus, inwiefern RnB Workshops einen Vorteil für Ihr Unternehmen und Produkt bringen: MTC Beitrag
Gerne beantworten wir auch Ihre individuelle Frage unter folgender Email Adresse: office@rnb-consulting.atNeuer Blog-Post!
Begrifflichkeiten des Vigilanzsystems
Was versteht man unter einer Reklamation, unerwünschten Nebenwirkungen, Vorkommnissen und schwerwiegenden Vorkommnissen?
Wir klären in unserem neuen Blog die Begrifflichkeiten und liefern eine grafische Darstellung des zu befolgenden Prozesses für das Management von Vorkommnissen und schwerwiegenden Vorkommnissen auf Grundlage des neuen MDCG 2023-3 Leitfadens.
Lesen Sie weiter in unserem neuen Blog Beitrag: Zum Beitrag
Zum Leifaden: MDCG 2023-3Neuer Blog-Post!
Medizinprodukte der Risikoklasse I
Leider kam es in jüngster Vergangenheit immer wieder zu Missverständnissen bezüglich der zu tätigenden Dokumentationen und Zertifizierungen eines reinen Klasse I Medizinproduktes. Wir fassen die wichtigsten Eckpunkte für Sie zusammen.
Lesen Sie mehr in unserem neuen Blog-Post: Zum Beitrag"Flugsimulator fürs Gehirn" - Podiumsdiskussion
Was nach Science-Fiction klingt, wird an der Johannes Kepler Universität Linz Realität.
Beim 4. JKU medTALK stand das Projekt “Medusa” im Mittelpunkt. Über die Herausforderungen und Chancen bei der Entwicklung einer revolutionären Trainingsplattform für Neurochirurg*innen wurde im JKU medLOFT am Campus der Medizinischen Fakultät der JKU angeregt diskutiert. Mit dabei R'n'B Consulting Geschäftsführerin DI.in Melanie Baumgartner, die über unsere Funktion beim Medusa-Projekt in den Bereichen Usability, Risikomanagement und Regulatorisches Rahmenwerk berichtet.
Am Podium diskutierten:
• Univ.-Prof. Dr. Andreas Gruber, Vorstand Universitätsklinik für Neurochirurgie, JKU
• DI.in Dr.in Julia Maier, JKU Institute of Polymer Product Engineering
• Dr. Michael Giretzlehner, RISC Software GmbH
• DI.in Melanie Baumgartner, RnB Consulting
Moderation:
• Dr.in Christine Haiden, Journalistin und Präsidentin des OÖ Presseclubs
Veröffentlichung der Leitlinie MDCG 2023-1 (In-house Produkte)
Guidance on the health institution exemption under Article 5(5) of Regulation (EU) 2017/745 and Regulation (EU) 2017/746
Medizinprodukte können innerhalb von EU-Gesundheitseinrichtungen (“in-house“) in nicht-industriellem Maßstab hergestellt und verwendet werden, um die spezifischen Bedürfnisse von Patientengruppen zu erfüllen die durch ein auf dem Markt befindliches, gleichwertiges Produkt mit CE-Kennzeichnung nicht oder nicht mit dem entsprechenden Leistungsniveau erfüllt werden können.
Die Bestimmungen in Artikel 5 Absatz 5 bilden die Grundlage für die behördliche Kontrolle und Überwachung von betriebsinternen Produkten. Das vorliegende Dokument enthält Leitlinien für die Anwendung einiger dieser Vorschriften. Es richtet sich an Angehörige der Gesundheitsberufe und Forscher in Gesundheitseinrichtungen, die hausinterne Produkte auslegen, herstellen, verändern und verwenden wollen.
Mit der Verordnung (EU) 2022/112 wurde die Anwendung einiger, aber nicht aller Bestimmungen für hauseigene IVDs aufgeschoben. Ein schematischer Überblick über den zeitlichen Ablauf der Anwendbarkeit von Artikel 5 Absatz 5 der IVDR findet sich in Anhang B dieses Leitfadens. Beachten Sie, dass der entsprechende Artikel 5(5) der MDR bereits seit dem 26. Mai 2021 vollständig anwendbar ist.
MDCG 2023-1Neuer Blog-Post! QMD Services - Die einzige Benannte Stelle Österreichs
Österreich hat eine neue Benannte Stelle für IVD Produkte!
Wir haben die näheren Informationen für Sie! Lesen Sie weiter in unserem Blog-Post: Blog-BeitragNeuer Blog Post!
Neue Übergangsverordnung
Die aktuelle Änderung hinsichtlich der Übergangsverordnung für bestimmte Medizinprodukte und In-vitro-Diagnostika - nach (EU) 2017/745 und (EU) 2017/746, veranschaulicht die gegenwärtige Problematik: Von zur Zeit 21.376 gültigen Zertifikaten nach RL 90/385/EWG (AIMD) für aktiv-implantierbare Medizinprodukte & RL 93/42/EWG (MDD) für allgemeine Medizinprodukte, laufen 4.311 im Jahr 2023 und 17.095 in den ersten 5 Monaten des Jahres 2024 aus. Lesen Sie weiter in unserem Blog-Post: Blog-BeitragR'n'B Consulting wünscht einen guten Rutsch ins neue Jahr!
R'n'B Consulting wünscht allen viel Glück, Erfolg und einen guten Rutsch ins neue Jahr ! Genießen Sie den Jahreswechsel mit Ihren Lieben, kommen Sie zur Ruhe und tanken Sie Kraft, damit das kommende Jahr schwungvoll gemeinsam gestartet werden kann.

R'n'B Consulting wünscht Frohe Weihnachten!
R'n'B Consulting GmbH wünscht allen erholsame Feiertage im Kreise der Liebsten!

Regelmäßig aktualisierter Bericht über die Sicherheit (PSUR) gemäß Artikel 86 (MDR) 2017/745
Veröffentlichung Leitlinie MDCG 2022 - 2021 am Dezember 2022
Das Hauptziel dieses Leitfadens besteht darin, die Hersteller bei der Umsetzung der in Artikel 86 MDR festgelegten rechtlichen Anforderungen hinsichtlich des regelmäßig aktualisierten Berichtes über die Sicherheit (PSUR) zu unterstützen. Die PSUR-Anforderungen im Rahmen der MDR erfordern eine einheitlichere, standardisierte und systematische Überprüfung aller Daten der Post-Market Surveillance (PMS) durch Hersteller von Produkten der Klassen IIa, IIb und III.
MDCG 2022-2021European Union reference laboratories (EURLs) in the field of in vitro diagnostic medical devices
Informationen für Bewerber-Referenzlaboratorien - 3. Version November 2022
Das im November veröffentlichte Dokument (Informationspaket) soll die wichtigsten Informationen über die Referenzlaboratorien in verständlicher Form zusammenfassen. Als IVD-Hersteller verschafft dieses Dokument einen besseren Überblick über die Referenzlaboratorien.
Referenzlaboratorien der EU überprüfen unter anderem durch Laboruntersuchungen, ob Produkte der höchsten Risikoklasse die vom Hersteller angegebene Leistung erbringen und den geltenden Gemeinsamen Spezifikationen, sofern solche verfügbar sind, oder anderen vom Hersteller gewählten Lösungen entsprechen, die ein mindestens gleichwertiges Sicherheits- und Leistungsniveau gewährleisten (Punkt(60) IVDR ).
Zum DokumentUpdate - Benannte Stellen
Anzahl der akkredidierten Stellen
Die 36. Benannte Stelle - für die Medizinprodukte-Verordnung (EU) 2017/745 (MDR) - ist nun auf der NANDO Datenbank der Europäischen Kommission gelistet. Mit den aktuell 7 Benannten Stellen, die für die In-Vitro-Verordnung (EU) 2017/746 gelistet sind, stehen nun gesamt 43 Benannte Stellen für die Konformitätsbewertung und Zertifizierung - basierend auf EU-Regularien für Medizinprodukte zur Verfügung.
Benannte Stellen MDR Benannte Stellen IVDRRnB - X-Mas-Special !
X-Mas Special
Auch wir möchten euch die vorweihnachtliche Zeit etwas versüßen! Da die Black-Friday-Aktion so gut angenommen wurde, möchten wir dieses Angebot verlängern!
10% Rabatt auf alle RnB-Workshops - diese findet ihr auf unserer Homepage im Bereich “Workshops” - die bis 31.12.22 gebucht werden! (Termine bzgl. Abhaltung der Workshops natürlich dann gerne ab 2023)
WorkshopsStart-ups aufgepasst !
Start-up Bonus
Sie sind neu in der MedTech-Branche, haben eine spitzen Produktidee, aber keine Erfahrung mit dem Zulassungsprozess von Medizinprodukten? Wir haben uns extra für Start-up-Unternehmen ein Support-Package überlegt.
Gemeinsam erarbeiten wir Ihre Produktidee und klären die Frage, ob sich Ihr Produkt überhaupt als Medizinprodukt qualifiziert.
Im nächsten Schritt erarbeiten wir gemeinsam, das einzuhaltende regulatorische Rahmenwerk.
So haben Sie die Möglichkeit, Ihr Zeit- und Kostenmanagement besser zu planen! Lesen Sie mehr dazu in unserem Start-up Bereich:
Start-up-SupportSie haben den Überblick über die MDR oder IVDR verloren und wissen nicht wie Sie diese am besten umsetzen?
Leitfaden IMDRF, MEDDEV, MDCG
Wir haben für Sie die wichtigsten Leitfaden Links, die Sie für Ihre Technische Dokumentation und der Umsetzung der MDR und IVDR benötigen.
* Leifaden der International Medical Device Regulators Forum: IMDRF Leifaden
* Leitfaden der Koordinierungsgruppe Medizinprodukte (MDCG): MDCG Leitfaden
* Konsens von verschieden Arbeitsgruppen: MEDDEV LeitfadenNeuer Blog Post!
Aufbau der technischen Dokumentation für IVDs - welche Auswirkung haben die Risikoklassen darauf?
Der regelmäßig aktualisierte Bericht über die Sicherheit (engl. Periodic Safety Update Report - PSUR), ist ein Dokument, das die Überwachungsdaten des Produkts nach dem Inverkehrbringen zusammenfasst. Die wichtigsten Punkte und welche Unterschiede es bzgl. der Risikoklasse beim PSUR gibt, finden Sie in unserem Blog-Post.
[[blog:2022:1024_aufbau_der_technischen_dokumentation_fuer_ivds_-_welche_auswirkung_haben_die_risikoklassen_daraufNeuer Blog Post!
Was ist der PSUR, was fordert dieser von Medizinprodukte-Herstellern und welche Unterschiede gibt es bzgl. Risikoklassen?
Der regelmäßig aktualisierte Bericht über die Sicherheit (engl. Periodic Safety Update Report - PSUR), ist ein Dokument, das die Überwachungsdaten des Produkts nach dem Inverkehrbringen zusammenfasst. Die wichtigsten Punkte und welche Unterschiede es bzgl. der Risikoklasse beim PSUR gibt, finden Sie in unserem Blog-Post.
Blog-BeitragUpdate - Benannte Stellen
Anzahl der akkredidierten Stellen
Die 34. Benannte Stelle für die Verordnung (EU) 2017/745 über Medizinprodukte (MDR) ist jetzt im NANDO-Informationssystem der Europäischen Kommission gelistet. Mit den benannten Stellen für die Verordnung (EU) 2017/746 über In-vitro-Diagnostika sind es nun insgesamt 41 Benannte Stellen.
Benannte Stellen MDR Benannte Stellen IVDRBest-Practice-Leitfaden für die Einreichung der Technischen Dokumentation
NB-Team Dokument vom 05.10.2022
Die häufigsten Gründe für Verzögerungen bei der Prüfung der technischen Dokumentation durch die benannten Stellen sind:
* Unvollständige Einreichungen - Unzureichende oder fehlende Informationen, die für die Konformitätsbewertungstätigkeiten erforderlich sind, werden nicht vorgelegt.
* Fehlende kohärente Struktur der Technischen Dokumentation - Die Informationen sind in der Technischen Dokumentation enthalten, aber schwer auffindbar.
Im folgenden Dokument finden Sie einen Best-Practice-Leitfaden für die Einreichung der Technischen Dokumentation gemäß Anhang II und III der Medizinprodukteverordnung (EU) 2017/745: Best-Practice Leitfaden Team-NB
Wer sind die Mitglieder des NB-Teams? Mitglieder Team-NBIVD-Hersteller (Klasse D)?
Gemeinsame Spezifikationen
Sie sind IVD-Hersteller (Klasse D) und haben den Überblick über die für Ihr(e) Produkt(e) einzuhaltenden “Gemeinsamen Spezifikationen” verloren oder vielleicht sogar noch gar nicht gefunden?
Wir haben eine Checkliste - direkt zum Ausarbeiten der einzelnen Anforderungen erstellt, die wir Ihnen gerne zur Verfügug stellen möchten.
Unverbindliche Anfrage zu unseren IVDR- und MDR-Services bitte direkt an: office@rnb-consulting.atIVD-Hersteller aufgepasst!
Sie brauchen Unterstützung hinsichtlich der IVDR geforderten Analysen und Dokumentationen?
Egal ob Nachweis der Einhaltung der allgemeinen Sicherheits- und Leistungsanforderungen, die vom Hersteller geforderte Bereitstellung von Informationen oder der Aufbau der gesamten technischen Dokumentation - wir helfen Ihnen gerne!
Zusammen analysieren wir Ihre bestehende Dokumentation und erarbeiten gemeinsam einen “Fahrplan” um den IVDR-Anforderungen möglichst rasch gerecht werden zu können.
Sie haben Fragen dazu oder zu einem unserer anderen Services? Kontaktieren Sie uns ganz unverbindlich unter: office@rnb-consulting.at.
Übergangsfristen der Technische Dokumentation nach MDR
Was für die unterschiedlichen Risikoklassen der Medizinprodukte zu beachten ist
Wir haben die wichtigsten Informationen bzgl. aktueller Übergangsfristen, der technischen Dokumentation und der verschiedenen Möglichkeiten der Zertifizierungsprozesse für Sie zusammengefasst.
Blog-BeitragUpdate - Benannte Stellen
Anzahl der akkredidierten Stellen
Die 32. Benannte Stelle für die Verordnung (EU) 2017/745 über Medizinprodukte (MDR) ist jetzt im NANDO-Informationssystem der Europäischen Kommission gelistet. Mit den benannten Stellen für die Verordnung (EU) 2017/746 über In-vitro-Diagnostika sind es nun insgesamt 39 Benannte Stellen.
Benannte Stellen MDR Benannte Stellen IVDR"Ein Ziel ohne Plan ist nur ein Wunsch"
Unsere RnB-Projektmanagement-Workshops starten im Herbst 2022!
Ziel des Projektmanagement Workshop ist es, ein grundlegendes Verständnis für das Projektmanagement zu erlangen. Anhand dieses Grundverständnisses werden anschließend die wichtigsten Instrumente und Methoden vorgestellt und mittels eigener Beispiele erarbeitet.
Seminarziele:
* Vermittlung der Projektmanagement Grundlagen (Begriffe, Rollen)
* Praxisumsetzung der PM Intrumente & Methoden (auch hinsichtlich Umsetzungprojekte der Medizintechnik-Branche)
Seminarinhalte:
* Begriffe und Rollendefinitionen
* Methoden und Instrumente – Erprobung an Beispielen
* Umfeldanalyse
* Projektstrukturplan
* GANTT
* Meilensteinplan
Am Ende des Seminars sind die Teilnehmer*innen in der Lage:
* Projektmanagement korrekt anzuwenden
* Die gängigsten PM Instrumente und Methoden am eigenen Projekt umzusetzenGemeinsame Spezifikationen für bestimmte In-vitro-Diagnostika der Klasse D
DURCHFÜHRUNGSVERORDNUNG (EU) 2022/1107 DER KOMMISSION vom 4. Juli 2022
Die Verordnung legt in 8 Anhängen die Gemeinsamen Spezifikationen für In-vitro Diagnostika der Klasse D dar. Nähere Informationen finden Sie unter folgendem Link:
Gemeinsame Spezifikationen Klasse D - IVD
Klinische Bewertung von Medizinprodukten - Unsere Workshops starten im Herbst!!
Unsere Workshops – individuell an Sie angepasst
Ziel der klinischen Bewertung ist die Darstellung der medizinischen Wirksamkeit und der sicherheitsrelevanten Eigenschaften des Medizinprodukts. Beide Aspekte sind in Form eines klinischen Nutzen/Risikoprofils abschließend zu vergleichen.
Dieses Seminar behandelt zwei Methoden, welche für die Recherche von klinischen Daten eingesetzt werden können:
- die Durchführung einer Literaturrecherche in anerkannten Datenbanken UND
- die Durchführung einer klinischen Prüfung am Menschen.
Die theoretischen Fachkenntnisse werden hierbei durch zahlreiche Beispiele aus der Praxis ergänzt. \\Zusätzlich werden Details zu den rechtlichen Grundlagen und zur geforderten Dokumentationsstruktur der klinischen Bewertung vermittelt.: RnB WorkshopsUsability-Workshop – Start im Herbst 2022!
Im Herbst starten unsere Usability-Workshops. Uns geht es nicht rein darum zu schulen, was normativ gefordert ist - im Gegenteil!
Der etwas andere Blickwinkel auf das Thema “Analyse der Gebrauchstauglichkeit” und vor allem die User Ihres Medizinproduktes stehen ganz klar im Vordergrund unseres eintägigen Workshops!
happy user = happy patient = happy manufacturer
UE WorkshopsRnB-Workshops – Start im Herbst 2022!
Unsere Workshops – individuell an Sie angepasst
Freuen Sie sich auf spannende und vor allem individuell auf Ihre Bedürfnisse angepasste Workshoptage! Mehr Informationen zu unseren Workshops finden Sie in unserem Blog-Beitrag: RnB WorkshopsErgebnisse einer bundesweiten Unternehmensumfrage zur MDR (Deutschland)
Umfrage zur MDR
Erste Bilanz der deutschen Hersteller von Medizinprodukten nach Geltungsbeginn der EU-Medizinprodukteverordnung (MDR):
Befragung zur EU-Medizinprodukteverordnung (DIHK, SPECTARIS und MedicalMountains)
Quellenangabe: „Befragung zur EU-Medizinprodukteverordnung von DIHK, SPECTARIS und MedicalMountains“VR4 Mind&Motion
Virtual Reality unterstütztes Training für Menschen mit Demenzerkrankung
Das folgende Video liefert einen kleinen Ausschnitt aus unserem wunderbaren VR4 Mind&Motion Projekt:
Projektpartner: Netural, amago, LIFEtool, Volkshilfe, R'n'B Consulting
Unterstützer: Land Oberösterreich, SCHILLER Handelsgesellschaft m.b.H., THERA-TrainerIVDR-Übergangsbestimmungen
MDCG-Dokument gibt Hinweise zu IVDR-Übergangsbestimmungen
Das aktuelle MDCG-Dokument gibt Hinweise zu wesentlichen Änderungen bezüglich der Übergangsbestimmung nach Artikel 110(3) der IVDR. Dieser Leitfaden soll das Konzept der „wesentlichen Veränderungen der Auslegung und Zweckbestimmung dieser Produkte“ gemäß Artikel 110 Absatz 3 der IVDR klarstellen. Es betrifft Hersteller von Produkten, die der Richtlinie 98/79/EG entsprechen und die nach dem 26. Mai 2022 während der Übergangszeit gemäß Artikel 110 Absatz 3 IVDR in Verkehr gebracht oder in Betrieb genommen werden.
MDCG 2022-6Update - Benannte Stellen
Anzahl der akkredidierten Stellen steigt
Die aktuellen Infos finden Sie mit Hilfe der hier angegebenen Links.
Benannte Stellen MDR Benannte Stellen IVDRMDCG 2022-5
Leitfaden zur Abgrenzung zwischen Medizinprodukten und Arzneimitteln
Im Link finden Sie den Leitfaden zur Abgrenzung zwischen Medizinprodukten und Arzneimitteln gemäß der Verordnung (EU) 2017/745 über Medizinprodukte.
MDCG 2022-5MDCG Subgroups - Veröffentlichung April 2022
Übersicht der geplanten Dokumente
Im folgenden Link finden Sie eine grobe Übersicht der geplante Guidance Dokumente und Deliverables der MDCG Subgroups.
On going Guidance April 2022Das MEDUSA-Konsortium durfte sich endlich wieder „in real“ treffen!
MEDUSA-Konsortium
Am Donnerstag den 31.03.2022 traf sich das MEDUSA-Konsortium an der FH-OÖ, Campus Linz, um den aktuellen Projektfortschritt gemeinsam zu besprechen. Der aktuelle Status zu einzelnen Arbeitspaketen, geplanten ToDos und weitere Vorgehensweisen konnten gemeinsam diskutiert und geplant werden.
Ein großes DANKE an die FH-OÖ, Campus Linz für die Gastfreundschaft!Schon von der EN ISO 20417 gehört?
EN ISO 20417
Vielleicht sogar schon reingelesen und so gar keinen Plan, wie diese umzusetzen ist? Wir haben alle Anforderungen dieser Norm zu einer praktischen Checkliste zusammengefasst, welche Sie wiederum ganz einfach mit Ihrer bestehenden Technischen Dokumentation verbinden können! Die Norm geht auf die seitens der Medizinprodukte-Hersteller zu bereitzustellenden Informationen ein und adressiert dabei nicht nur die Gebrauchsanweisung, sondern unter anderem auch alle Etikettierung, darauf zwingend anzubringende Symbole und zu leistende Qualitätsprüfungen. Sie haben Fragen zu dieser Norm und/oder unserer EN-ISO-20417-Checkliste?
Melden Sie sich ganz unverbindlich via office@rnb-consulting.at
Neue Büroräumlichkeiten!
Wir sind umgezogen!
Wir fühlen uns in unseren neuen Büroräumlichkeiten so richtig wohl! Wir freuen uns auf neue, herausfordernde und vor allem spannende Projekte! So viel dürfen wir verraten: Schon bald gibt es BIG NEWS.
Unsere neue Adresse:
Steingasse 6a
4020 Linz

Leitfaden zur Einreichung der elektronischen Gebrauchsanweisung
Hilfestellung zur elektronischen Gebrauchsanweisung
Dieser Leitfaden dient als Hilfestellung, welche Dokumente notwendig sind, um eine Prüfung der eingereichten Unterlagen für eine elektronische Gebrauchsanweisung reibungslos zu ermöglichen.
Leitfaden zur Einreichung der elektronischen GebrauchsanweisungUpdate - Benannte Stellen in der NANDO Datenbank
Update der Benannten Stellen
Die 27. Benannte Stelle für die Verordnung (EU) 2017/745 über Medizinprodukte (MDR) ist jetzt im NANDO-Informationssystem der Europäischen Kommission gelistet. Mit den benannten Stellen für die Verordnung (EU) 2017/746 über In-vitro-Diagnostika sind es nun insgesamt 33 Benannte Stellen.
Benannte Stellen MDR Benannte Stellen IVDRMDCG Leitfaden vom Jänner 2022 über die allgemeinen Grundsätzen des klinischen Nachweises für In-vitro-Diagnostika
Guidance on general principles of clinical evidence for In Vitro Diagnostic medical devices (IVDs)
Dieses Dokument beschreibt die allgemeinen Grundsätze des klinischen Nachweises und bietet eine Anleitung für den kontinuierlichen Prozess der Leistungsbewertung von In-vitro-Diagnostika.
MDCG 2022-2Änderung der Verordnung (EU) 2017/746 hinsichtlich der Übergangsbestimmungen für bestimmte IVD und des späteren Geltungsbeginns der Bedingungen für hausinterne Produkte
Änderung der Verordnung (EU) 2017/746
Hinsichtlich dem Geltungsbeginn zur Eigenherstellung von IVDs in Gesundheitseinrichtung, hat die EU Kommission den vorgestellten Vorschlag der Übergangsfristen am 25.01.2022 übernommen.
LinkElektronische Gebrauchsanweisung
DURCHFÜHRUNGSVERORDNUNG (EU) 2021/2226 DER KOMMISSION
Bei einigen Medizinprodukten kann die Bereitstellung von Gebrauchsanweisungen in elektronischer Form statt in Papierform vorteilhaft sein. Es kann die Umweltbelastung verringern und die Kosten für die Medizinprodukteindustrie senken, während das Sicherheitsniveau aufrechterhalten oder verbessert wird.
DurchführungsverordnungIVDR - Geändertes Inkraftsetzungsdatum!
Änderung des Inkrafttretens basierend auf Risikoklassifizierung der IVDs
Die ursprüngliche IVD-Verordnung von 2017 führte wesentliche Änderungen des Rechtsrahmens für In-vitro-Diagnostika wie HIV-Tests, Schwangerschaftstests oder SARS-CoV-2-Tests ein. Konformitätsbewertungsstellen (sogenannte „benannte Stellen“) werden mit Einführung eine noch wichtigere Rolle spielen, da das gesamte Klassifizierungssystem überarbeitet wurde. Insgesamt gilt die IVD-Verordnung unverändert und planmäßig ab dem 26. Mai 2022, allerdings besteht ein gravierender Mangel an Kapazitäten der benannten Stellen. Dies macht es den Herstellern unmöglich, die gesetzlich vorgeschriebenen Konformitätsbewertungsverfahren rechtzeitig durchzuführen. Ohne entsprechender Maßnahmen seitens der Kommission bestand das Risiko einer erheblichen Beeinträchtigung der Versorgung mit verschiedenen wichtigen In-vitro-Diagnostika auf dem Markt, insbesondere einem negativen Einfluss der Diagnose von Patienten und dem Zugang zu relevanter Gesundheitsversorgung.
• Für CE-gekennzeichnete Produkte, die keine Beteiligung einer benannten Stelle gemäß der IVD-Verordnung erfordern, gilt die IVD-Verordnung wie geplant ab dem 26. Mai 2022.
Die Geltungsdaten der IVDR für bestimmte Medizinprodukte ändern sich aber:
• Für Produkte mit höherem Risiko wie HIV- oder Hepatitis-Tests (Klasse D) gelten die neuen Anforderungen ab 26.Mai 2025.
• Für Produkte der niedrigeren Risikoklasse C, wie bestimmte Influenza-Tests, verlängert sich die Geltungsdauer bis 26. Mai 2026
• Für Produkte der Klasse B und sterile Klasse A IVDs beginnt die Geltungsdauer mit 26. Mai 2027.
• Darüber hinaus verzögert sich die Anwendung bestimmter Anforderungen für Produkte, die in derselben Gesundheitseinrichtung hergestellt und verwendet werden (sog. “hausinterne Produkte”) generell um zwei Jahre bis Mai 2024. Allerdings ist zu beachten, dass das Kriterium, dass eine In-House Produktion zurecht vorliegt (Siehe IVDR Artikel 5 (5), Punkt d: Es darf kein gleichwertiges Produkt am Markt verfügbar sein) bis zum 26. Mai 2028 nachzuweisen ist.
Link zum konsolidierten TextÄnderung des Durchführungsbeschlusses (EU) 2021/1182 in Bezug auf harmonisierte Normen
DURCHFÜHRUNGSBESCHLUSS (EU) 2022/6 DER KOMMISSION vom 4. Januar 2022
Im Anhang des Durchführungsbeschlusses (EU) 2021/1182 werden folgende harmonisierte Normen und Änderungen ergänzt:
 Durchführungsbeschluss 4.Jänner 2022
Durchführungsbeschluss 4.Jänner 2022
Usability Engineering - angepasst an Ihr Medizinprodukt!
Der Alltag von Gesundheitsdienstleistern ist geprägt von der Anwendung innovativer Medizinprodukte. Auch in den eigenen vier Wänden nehmen immer mehr medizintechnische Gerätschaften einen fixen Platz ein und werden in das alltägliche Leben integriert. Lesen Sie in unserem aktuallen Blog, wie Sie gemeinsam mit uns den Anforderungen der EN 62366-1-2015:A1:2020 gerecht werden können.
Link zum BlogartikelNeue Benannte Stelle - akkreditiert nach MDR!
Die 26. Benannte Stelle - TÜV NORD - für die Verordnung (EU) 2017/745 über Medizinprodukte (MDR) ist jetzt im NANDO-Informationssystem der Europäischen Kommission gelistet:
NANDO-Übersicht
Die IVDR wurde durch das Europäische Parlament angenommen!
Die Verordnung über In-vitro-Diagnostika, die ab dem 26. Mai 2022 gelten wird, kann nun dank der Annahme durch das Europäische Parlament und den Rat schrittweise eingeführt werden.
Link zum Artikel
R'n'B Consulting wünscht Frohe Weihnachten!
R'n'B Consulting GmbH wünscht allen erholsame Feiertage im Kreise der Liebsten!

„Stheno v1.0“ erfolgreich fertiggestellt
MEDUSA
Nach rund zwei Jahren ist es so weit: Das Konsortium des Forschungsprojekts „Medical EDUcation in Surgical Aneurysm clipping (MEDUSA)“ hat den ersten Prototyp „Stheno v1.0“ erfolgreich fertiggestellt.
Link zum Medusa-BlogMDCG 2021-27
EUDAMED
Dieses Dokument enthält Fragen und Antworten zu den Anforderungen an Importeure und Händler gemäß der Verordnung (EU) 2017/745 über Medizinprodukte (MDR) und der Verordnung (EU) 2017/746 über In-vitro-Diagnostika (IVDR).
MDCG 2021-27DURCHFÜHRUNGSVERORDNUNG (EU) 2021/2078 der Kommission vom 26. November 2021
EUDAMED
Durchführungsbestimmungen zur Verordnung (EU) 2017/745 des Europäischen Parlaments und des Rates hinsichtlich der Europäischen Datenbank für Medizinprodukte (Eudamed).
DURCHFÜHRUNGSVERORDNUNG (EU) 2021/2078 DER KOMMISSIONAktueller Stand - Benannte Stellen in der NANDO Datenbank
Es geht voran!
Bereits 25 benannte Stellen für die Verordnung (EU) 2017/745 über Medizinprodukte sind nun in der NANDO Datenbank gelistet. Mit den benannten Stellen für die Verordnung (EU) 2017/746 über In-vitro-Diagnostika sind es bereits insgesamt 31 benannte Stellen.
Benannte Stellen MDR Benannte Stellen IVDRVerwendung von Symbolen, um den MDR-Anforderungen gerecht zu werden
Neue Guideline der MedTech Europe liefert Hilfestellung bzgl. Verwendung von Symbolen bei Medizinprodukten
Dieser Leitfaden hilft, den MDR-Anforderungen zusammen mit jenen der ISO 15223-1 gerecht zu werden.
Use of Symbols to Indicate Compliance with the MDRMDCG 2021-24 - Guidance on classification of medical devices
Unterstützung bei der Klassifzierung von Medizinprodukten
Dieses Dokument dient als Leitfaden für den Hersteller, um die Klassifizierung seines Medizinproduktes zu bestimmen.
MDCG 2021-24Clinical Evidence Requirements for CE certification under the Diagnostic Regulation in the European Union
Dieses Dokument dient als Leitfaden mit einer Sammlung von Fragen und Antworten, die den Herstellern helfen sollen, ihre Verpflichtungen zur Leistungsbewertung gemäß der neuen IVD-Verordnung 2017/746 zu erfüllen.
MedTech EuropeUsability von IVDs
Sie sind Hersteller von In vitro Diagnostika und haben sich bis dato wenig bis kaum mit dem Thema Usability Engineering auseinandergesetzt? Lesen Sie Aktuelles zu diesem Thema in unserem Blog-Beitrag
Blog IVDR & UE Link auf IVDRAktueller Stand - Benannte Stellen in der NANDO Datenbank
Bereits 24 benannte Stellen für die Verordnung (EU) 2017/745 über Medizinprodukte sind nun in der NANDO Datenbank gelistet. Mit den benannten Stellen für die Verordnung (EU) 2017/746 über In-vitro-Diagnostika sind es bereits insgesamt 30 benannte Stellen.
Kleiner Tipp: Unter den benannten Stellen sind PDFs zu finden, in denen die MDR/IVDR Codes der jeweiligen benannten Stelle angegeben sind, unter denen sie tätig werden darf.
Benannte Stellen IVDR Benannte Stellen MDRVerlängerung der IVDR-Übergangsfrist!
Inhaltliche Anforderungen der IVDR bleiben bestehen, lediglich der Geltungsbeginn soll erneuert werden. Für Produkte mit höherem Risikopotential (Klasse D) und bestimmte Influenza-Tests (Klasse C, gilt eine mögliche Übergansfrist bis Mai 2025 bzw. 2026. Im Vergleich dazu wäre die Übergangsfrist für Produkte mit geringerem Risiko (Klasse A und B) bis Mai 2027 zukünftig möglich.
Link zum DokumentNeuer Blog Post!
Künstliche Intelligenz in der Medizin - Fluch und Segen zugleich
Lesen Sie Näheres in unserem Blog Artikel “Künstliche Intelligenz in der Medizin”:
Link zum ArtikelNeues MPG in Österreich
Neues MPG
Die Regierungsparteien stimmten im Ausschuss einem Abänderungsantrag des MPG zu. Anlass für die Neufassung des Medizinproduktegesetzes ist eine Änderung der europäischen Rechtslage.
Bundesgesetz, Änderung des MedizinproduktegesetzesKlassifizierung IVDR
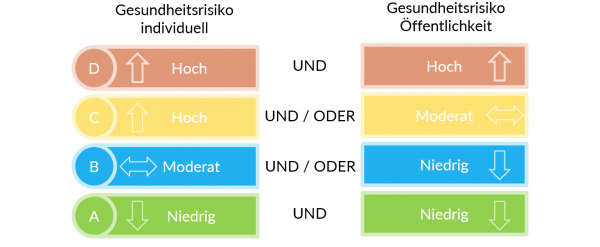
Die Klassifizierung ist abhängig vom Gesundheitsrisiko
Die Klassifizierungsregeln der In-vitro Diagnostika basieren im Wesentlichen auf den GHTF-Regeln (GHTF/SG1/N045:2008), dieses Dokument ist jedoch durch das neue IMDRF Dokument abgelöst worden ( IMDRF/IVD WG/N64FINAL:2021). Nähere Erläuterungen siehe auch MDCG Klassifizierung IVD ( MDCG 2020-16).
Beispiele für die Klassifizierungen:
A: Klinisch-chemisches Analysegerät
B: Vitamin B12, Schwangerschafts-Selbsttest, Urinteststreifen
C: Blutzucker-Selbsttests, HLA-Typisierung, PSA-Screening, Röteln
D: HIV-Blutspender-Screening, HIV-Blutdiagnostik
Public Health - Medical Device Sector
Regulatorische Historie und die wichtigsten Publikationen auf einen Blick
Auf der Seite der EU-Kommission finden Sie die wichtigsten Informationen zum regulatorischen Rahmenwerk der Medizintechnik-Branche:
Overview Public Health
Event Reminder!
LISAvienna Regulatory Konferenz für Medizinprodukte und In-vitro Diagnostika
Am 12.10.2021 findet die LISAvienna Regulatory Konferenz in Wien statt. Die Teilnahme an der Veranstaltung ist kostenlos. Nähere Informationen finden Sie unter:
Informationen und Anmeldung
ProgrammheftAktueller Stand - Benannte Stellen in der NANDO Datenbank
Die 23. Benannte Stelle für die Verordnung (EU) 2017/745 über Medizinprodukte ist nun im NANDO-Informationssystem der Europäischen Kommission gelistet:
Benannte Stellen MDRBenötigen Sie Unterstützung bei der Implementierung der MDR und IVDR?
Wir haben die richtigen Bücher für Sie!
Buchempfehlung 1: Clinical Evaluation and Investigation of Medical Devices under the new EU-Regulation (EN)
Clinical Evaluation and Investigation: This book provides in-depth and practice-oriented guidance on the systematic identification and generation of clinical data through clinical investigations and other relevant sources. It addresses the needs of all stakeholders, be it manufacturers, notified bodies or competent authorities, when they have to plan, perform or assess clinical evaluations and investigations for medical devices on the way to conformity assessment and CE marking.
Buchempfehlung 2: Medizinprodukte und IVD (DE)
Medizinprodukte und IVD: Das Buch liefert einen gründlichen, kompakten Einblick in die neuen Regularien und stellt ein Navigationssystem für eine rasche Orientierung bereit. Komplexe Sachverhalte werden übersichtlich und praxisnah mit zahlreichen Tipps aufbereitet. Sie werden von den Verordnungen auch zu den wichtigen interpretativen Dokumenten des Sektors geleitet, die nützliche Entscheidungsgrundlagen bereithalten.
Clinical Investigation and Evaluation of Medical Devices under the new EU-Regulation
Medizinprodukte und IVD - Fit für EuropaAktueller Stand - Benannte Stellen in der NANDO Datenbank
Auch die sechste benannte Stelle für die Verordnung (EU) 2017/746 über In-vitro-Diagnostika ist nun in der NANDO Datenbank veröffentlicht worden. Für die Verordnung (EU) 2017/745 gibt es derzeit 22 benannte Stellen. Insgesamt gibt es somit bereits 28 benannte Stellen für die neuen Verordnungen.
Kleiner Tipp: Unter den benannten Stellen sind PDFs zu finden, in denen die MDR/IVDR Codes der jeweiligen benannten Stelle angegeben sind, unter denen sie tätig werden darf.
Benannte Stellen IVDR Benannte Stellen MDRGlobal Approach - Was ist das?
Im Global Approach geht es um die Konfomitätsbewertung („Eurozulassung“) von Produkten auf der Basis modularer Konformitätsbewertungsverfahren, die je nach Risikoklasse des Produktes ausgewählt werden müssen. Sie wissen nicht, wie Sie für Ihr Medizinprodukte vorzugehen haben? Kontaktieren Sie uns und holen Sie sich im Idealfall auch alle wichtigen Infos aus dem aktuellen Buch:
Medizinprodukte und IVDSind Sie schon vorbereitet?
Der IVDR Geltungsbeginn rückt immer näher
Eine frühe Vorbereitung auf die Verordnung ist das Um und Auf. Lesen Sie näheres zum IVDR Geltungsbeginn in unserem Blog-Artikel.
Link zum ArtikelNeuer Blog Post!
Meilensteine VOR Markteinführung
Lesen Sie Näheres in unserem Blog Artikel “Meilensteine vor Markeintführung”:
Link zum ArtikelMDCG - 2021-14 Explanatory note on IVDR codes
IVDR Codes
Dieser Leitfaden soll die verschiedenen Ebenen der IVDR Codes und ihre Verwendung erläutern, einschließlich der Verwendung von Bedingungen, um eine harmonisierte Verwendung der Codes insbesondere für die Zuweisung von Ressourcen für Konformitätsbewertungstätigkeiten sicherzustellen. Dadurch wird sichergestellt, dass sowohl die benannte Stelle als auch das mit der Konformitätsbewertung beauftragte Personal über die volle Kompetenz für die Produkte verfügen, die sie bewerten sollen.
MDCG IVDR codes IVDR Code ÜbersichtMDR, IVDR Art. 15 - „Für die Einhaltung der Regulierungsvorschriften verantwortliche Person“
Etablierung einer verantwortlichen Person
Völlig unabhängig davon, welche Arten von Medizinprodukten Sie in Verkehr bringen, unabhängig von der Risikoklasse des Produktes und - des Weiteren - vollkommen unabhängig davon, ob Sie eine benannte Stelle für die Zulassung benötigen oder nicht: Sie müssen eine „Verantwortliche Person“ etablieren.
Leitfaden PRRCUDI Helpdesk - European Commission
Unterstützung UDI - Kennzeichnung - Registrierung
Dieser Helpdesk dient zur Unterstützung bei der Umsetzung von Verpflichtungen und Anforderungen des UDI-Systems. Sie finden hier Hilfe zur UDI-Zuweisung, Kennzeichnung und Registrierung von Medizinprodukten.
UDI HelpdeskFragen & Antworten: Geltungsbeginn der Verordnung über Medizinprodukte!
EU-Vorschriften für die Sicherheit von Medizinprodukten
Fragen hinsichtlich der Vorteile für Patienten, der betroffenen Produkte, der Sicherheit, den aktuellen Stand der EUDAMED und viele mehr werden beantwortet. Hier finden Sie den Link zu den Fragen & Antworten:
ArtikelNeuer Blog Post!
Es war einmal die MDD…
Mit heutigem Datum 26.05.21 erlangt die MDR ihre vollständige Gültigkeit. Medizinprodukte müssen nach MDR zugelassen werden, um In-verkehr gebracht werden zu dürfen. Näheres finden Sie in unserem Blog Artikel:
Link zum ArtikelIMDRF Dokument vom 21.01.21 - Principles of In Vitro Diagnostic (IVD) Medical Devices Classification
Klassifizierung von IVD
Grundlagen der In-Vitro-Diagnostik (IVD) Medizinprodukte-Klassifizierung und Faktoren die sie beeinflussen:
Zum IMDRF Dokument