MDR Teil 6 - Konformitätsbewertungsverfahren
Der sechste Teil unserer MDR-Blog-Artikel-Reihe beschäftigt sich mit den durch die MDR geforderten Konformitätsbewertungsverfahren. Wie bereits aus der RL 93/42/EWG bekannt, stellt auch die MDR - je nach Risikoklasse des Medizinproduktes - unterschiedliche wählbare Wege des Konformitätsbewertungsverfahrens zur Verfügung.
Überblick - Forderung der MDR
Bevor ein Hersteller sein Produkt in Verkehr bringt, muss eine Bewertung der Konformität des betreffenden Produktes in Anlehnung an die in den Anhängen IX - XI zu findenden Konformitätsbewertungsverfahren durchgeführt werden. Wie auch bereits aus der RL 93/42/EWG bekannt, hängt die Wahl des Konformitätsbewertungsfahrens von der Risikoklasse des Medizinproduktes ab:
- I
- Im (Medizinprodukte mit Messfunktion)
- Is (Sterile Medizinprodukte)
- Iwci (Wiederverwendbare chirurgische Medizinprodukte - Abkürzung (Iwci) in MDR nicht definiert)
- IIa
- IIb
- III
Ziel der Konformitätsbewertung ist die Erbringung des Nachweises, dass das Medizinprodukt die Sicherheits- und Leistungsanforderungen der MDR aus Anhang I auch tatsächlich erfüllt. Im Vergleich dazu bedeutet die Konformitätsbewertung auf Basis der RL 93/42/EWG die Erbringung des Nachweises, dass die grundlegnden Anforderungen aus Anhang I erfüllt sind.
Der Weg zur CE-Kennzeichnung
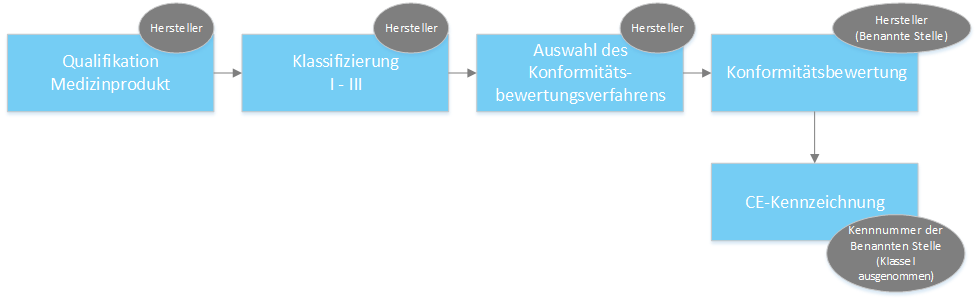
Erläuterung der zu wählenden Konformitätsbewertungsverfahren pro Risikoklasse
(ausgenommen Sonderanfertigungen & Prüfprodukte)
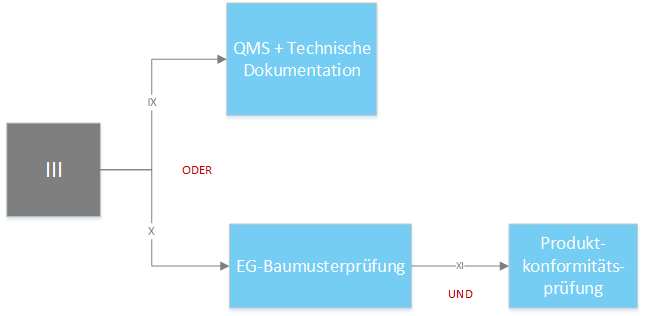
Produkte der Klasse III - Konformitätsbewertungsverfahren gemäß Anhang IX “Konformitätsbewertung QMS und Technische Dokumentation”. Alternativ kann das Konformitätsbewertungsverfahren gemäß Anhang X “Baumusterprüfung” in Kombination mit Anhang XI “Produktkonformitätsprüfung” gewählt werden.
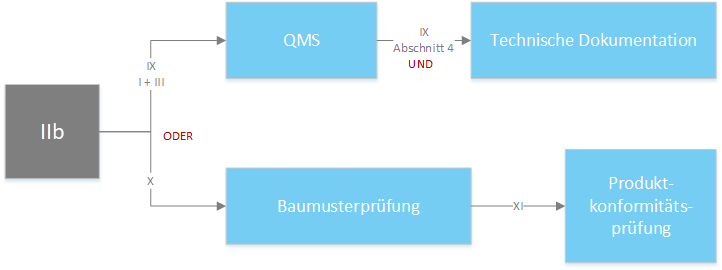
Produkte der Klasse IIb - Konformitätsbewertungsverfahren gemäß Anhang IX “Konformitätsbewertung QMS und Technische Dokumenation” Kapitel I (QMS) und III (Verwaltungsbestimmungen) , sowie der Bewertung der technischen Dokumentation gemäß Abschnitt 4 des Anhang IX für zumindest eines repräsentativen Produktes pro generischer Produktgruppe.
Produkte der Klasse IIb - Für implantierbare Produkte der Klasse IIb wird die Bewertung der technischen Dokumentation nach Anhang IX Abschnitt 4 jedoch für jedes Produkt vorgenommen. (ausgenommen: Nahtmaterial, Klammern, Zahnfüllungen, Zahnspangen, Zahnkronen, Schrauben, Keile, Zahn- bzw. Knochenplatten, Drähte, Stifte und Verbindungsstücke) Alternativ kann das Konformitätsbewertungsverfahren nach Anhang X “Baumusterprüfung” in Kombination mit dem Konformitätsbewertungsverfahren nach Anhang XI “Produktkonformitätsprüfung” gewählt werden.
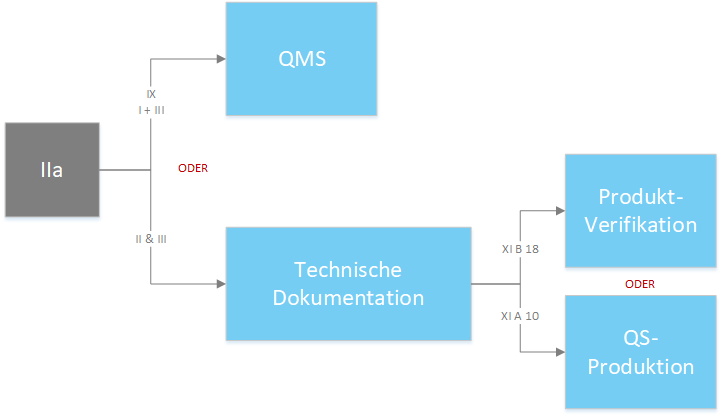
Produkte der Klasse IIa - Konformitätsbewertungsverfahren gemäß Anhang IX “Konformitätsbewertung QMS und Technische Dokumentation” Kapitel I (QMS) und III inkl. einer Bewertung der technischen Dokumentation gemäß Abschnitt 4 des Anhang IX für zumindest eines repräsentativen Produktes pro generischer Produktgruppe. Alternativ kann die auf Grundlage von Anhang II und Anhang III erstellte technische Dokumentation durch Abschnitt 10 oder Abschnitt 18 des Anhanges XI bewertet werden.
Produkte der Klasse I - Für reine Klasse I Medizinprodukte stellt der Hersteller selbst die EU-Konformitätserklärung aus (Artikel 19). Bei Produkten mit Messfunktion, sterilen Produkten oder bei wiederverwendbaren chirurgischen Produkten benötigt der Hersteller für die 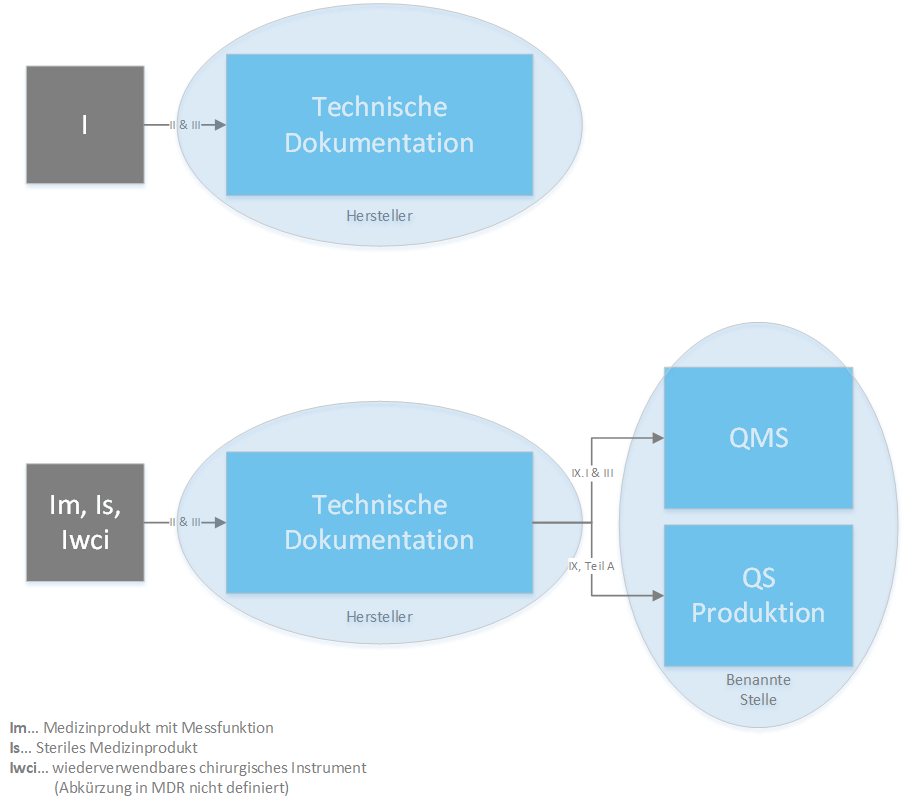
Sonderanfertigungen - Bei Sonderanfertigungen ist das Konformitätsbewertungsverfahren gemäß Anhang XIII zu wählen.
QMS für alle
Im Zuge der Betrachtung der aus der MDR geforderten Konformitätsbewertungsverfahren ist besonders das Qualitätsmanagement hervorzuheben. Die MDR fordert von allen Herstellern - Risikoklasse I-III - das Definieren, Dokumentieren und vor allem “Leben” eines QM-Systems.