Aufbau der Technischen Dokumentation für IVDs - Welche Auswirkung haben die Risikoklassen darauf?
IVDs sind in folgende Klassen unterteilt:
| Risikoklasse | Beispiele |
|---|---|
| D | HIV, Syphilis |
| C | HLA, Rubella |
| B | Blutgase, physiologische Marker: Hormone |
| A | Pufferlösungen, Probenbehältnisse |
Aktuell begleiten wir den Aufbau der Technischen Dokumentation für ein Klasse A IVD. Auch wenn in diese IVD-Klasse unkritische Produkte wie bspw. Probenbehältnisse oder Instrumente für die Verwendung bei In-vitro Diagnoseverfahren fallen, ist die Einhaltung der Grundlegenden Sicherheits- und Leistungsanforderungen (IVDR, Anhang I) obligatorisch.
In diesem Zusammenhang ist eine wichtige Information zu erwähnen: IVD-Hersteller aller IVD-Klassen sind somit verpflichtet:
- Ein QM aufzubauen
- Die Gebrauchstauglichkeit nach EN 62366 nachzuweisen
- Die direkte Verbindung zum Risikomanagement nach EN 14971 herzustellen
- Verifizierungen und Validierungen des Produktes nachzuweisen
Was jedoch den größeren Unterschied der IVD-Klassen untereinander auszeichnet, ist der zu wählende Zertifizierungsprozess. Reine Klasse A IVDs benötigen keine BS (Benannte Stelle) und Hersteller dieser IVD-Klassen, können die Konformitätserklärung eigenständig ausstellen.
Bei In-vitro Diagnostika der Klasse A steril wird seitens des Herstellers eine Technische Dokumentation erstellt und Teilbereiche des Qualitätsmangementsystem seitens der Benannten Stelle geprüft.
Bei Klasse B und C IVDs ist die Benannte Stelle dazu verpflichtet, das Qualitätsmanagementsystem und die Technische Dokumentation zu prüfen.
Bei Klasse D IVDs wird eine detailreiche Auditierung durchgeführt. Das Referenzlaboratorium (Artikel 100 IVDR) ist in die Prüfungen miteinbezogen (Überprüfung der vom Hersteller angegebenen Leistung und ggf. der Einhaltung der Gemeinsamen Spezifikationen). Gemäß Artikel 50 IVDR kann die Koordinierungsgruppe Medizinprodukte und ggf. Kommission bei begründeten Bedenken die Expertengremien miteinbeziehen, um wissenschaftliche Gutachten zur Sicherheit und Leistung von Produkten zu erhalten.
Nähere Informationen zu den Konformitätsbewertungsverfahren finden Sie im foglenden Bild:
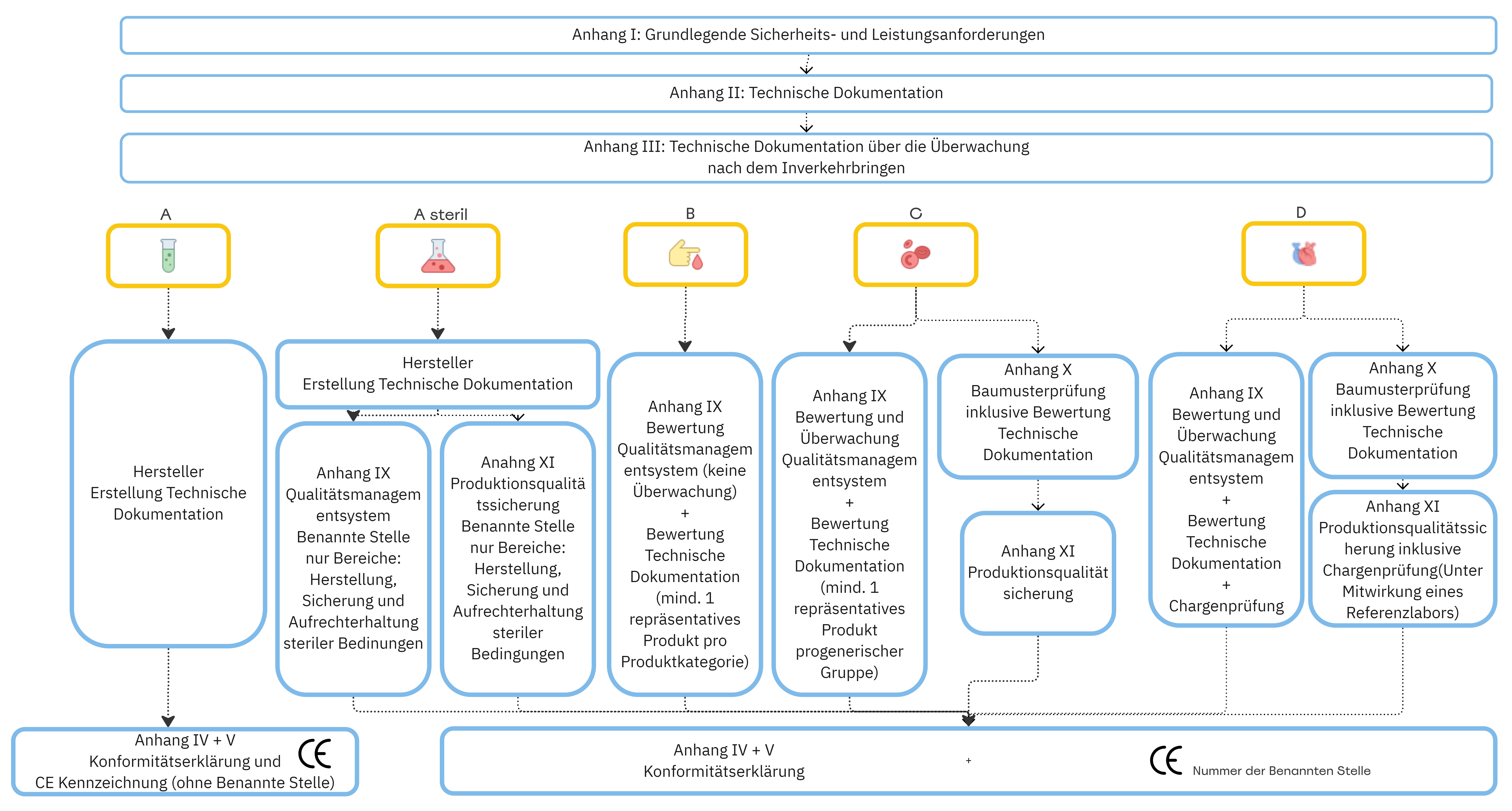
Bildquelle: TÜV SÜD Seminar In-vitro-Diagnostika - Inhalte und Umsetzung der neuen europäischen IVD-Verordnung